Uranium heksafluorida
senyawa kimia
(Dialihkan dari Uranium(VI) fluoride)
Artikel ini perlu dikembangkan dari artikel terkait di Wikipedia bahasa Jerman. (Februari 2024)
klik [tampil] untuk melihat petunjuk sebelum menerjemahkan.
|
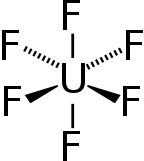
Uranium heksafluorida, terkadang disebut heks, adalah sebuah senyawa anorganik dengan rumus UF6. Uranium heksafluorida adalah padatan putih volatil yang dapat bereaksi dengan air, melepaskan asam fluorida korosif. Senyawa ini bereaksi ringan dengan aluminium, membentuk lapisan permukaan tipis AlF
3 yang menahan reaksi lebih lanjut dari senyawa ini. UF
6 digunakan dalam proses pengayaan uranium, yang menghasilkan bahan bakar untuk reaktor nuklir dan senjata nuklir.
| |
| |
| |
| Nama | |
|---|---|
| Nama IUPAC
Uranium heksafluorida
Uranium(VI) fluorida | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| Singkatan | hex |
| ChEBI | |
| ChemSpider | |
| Nomor EC | |
| Referensi Gmelin | 2923 |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
| Nomor UN | 2978 (<1% 235 U) 2977 (>1% 235 U) |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| UF 6 | |
| Massa molar | 352,02 g/mol |
| Penampilan | Padatan nirwarna |
| Densitas | 5,09 g/cm3, padatan |
| Titik didih | 56,5 °C (133,7 °F; 329,6 K) (menyublim, pada tekanan atmosfer) |
| Terhidrolisis | |
| Kelarutan | |
| Struktur | |
| Ortorombik, oP28 | |
| Pnma, No. 62 | |
| Oktahedral (Oh) | |
| 0 | |
| Termokimia | |
| Entropi molar standar (S |
|
| Entalpi pembentukan standar (ΔfH |
|
| Bahaya | |
| Bahaya utama | Beracun, korosif, radioaktif[3] |
| Lembar data keselamatan | ICSC 1250 |
| Piktogram GHS |   
|
| Keterangan bahaya GHS | {{{value}}} |
| H300, H330, H373, H411 | |
| Titik nyala | Tak mudah terbakar |
| Senyawa terkait | |
Anion lain
|
Uranium heksaklorida |
Kation lainnya
|
|
Related Uranium fluorida
|
|
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Referensi
sunting- ^ "Uranium Hexafluoride". Diarsipkan dari versi asli tanggal 16 September 2013. Diakses tanggal 8 Februari 2024.
- ^ a b c d Johnson, Gerald K. (1979). "The Enthalpy of Formation of Uranium Hexafluoride". The Journal of Chemical Thermodynamics. 11 (5): 483–490. doi:10.1016/0021-9614(79)90126-5.
- ^ Uranium(VI) fluoride
Bacaan lebih lanjut
sunting- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil A, p. 121–123.
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, p. 71–163.
- R. DeWitt: Uranium hexafluoride: A survey of the physico-chemical properties, Technical report, GAT-280; Goodyear Atomic Corp., Portsmouth, Ohio; 12. August 1960; DOI:10.2172/4025868.
- Ingmar Grenthe, Janusz Drożdżynński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt, Stephen F. Wolf: Uranium Diarsipkan 2012-01-18 di Wayback Machine., in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, p. 253–698; DOI:10.1007/1-4020-3598-5_5 (p. 530–531, 557–564).
- US-Patent 2535572: Preparation of UF6; 26. December 1950.
- US-Patent 5723837: Uranium Hexafluoride Purification; 3. March 1998.
Pranala luar
suntingWikimedia Commons memiliki media mengenai Uranium hexafluoride.
- (Inggris) Simon Cotton (Uppingham School, Rutland, UK): Uranium Hexafluoride.
- (Inggris) Uranium Hexafluoride (UF6) – Physical and chemical properties of UF6, and its use in uranium processing – Uranium Hexafluoride and Its Properties
- (Inggris) Uranium Hexafluoride at WebElements
- (Inggris) Import of Western depleted uranium hexafluoride (uranium tails) to Russia [pranala mati 30 Juni 2017]