Reseptor terhubung protein G
Reseptor terhubung protein G (GPCR), juga dikenal sebagai reseptor domain tujuh transmembran, reseptor 7TM, reseptor heptaheliks, reseptor serpentin, dan reseptor terkait protein G (GPLR), merupakan famili protein besar dari reseptor yang mendeteksi molekul di luar sel dan mengaktifkan jalur transduksi sinyal internal dan memberikan respons seluler.[2]
| GPCR | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifikasi | |||||||||
| Simbol | 7tm_1 | ||||||||
| Pfam | PF00001 | ||||||||
| InterPro | IPR000276 | ||||||||
| PROSITE | PDOC00210 | ||||||||
| TCDB | 9.A.14 | ||||||||
| OPM superfamily | 6 | ||||||||
| OPM protein | 1gzm | ||||||||
| CDD | cd14964 | ||||||||
| |||||||||
Reseptor terhubung protein G hanya ditemukan pada eukariota, termasuk khamir, choanoflagellata,[3] dan hewan. Ligan yang mengikat dan mengaktifkan reseptor ini termasuk senyawa sensitif cahaya, bau, feromon, hormon, dan neurotransmiter, dan bervariasi dalam ukuran dari molekul kecil ke peptida hingga protein besar. Reseptor terhubung protein G terlibat dalam banyak penyakit, dan juga merupakan target sekitar 34% dari semua obat-obatan modern.[4][5][6]
Ada dua jalur transduksi sinyal utama yang melibatkan reseptor terhubung protein G yaitu jalur sinyal cAMP dan jalur sinyal fosfatidlinositol.[7]
Ketika ligan mengikat GPCR, ligan menyebabkan perubahan konformasi pada GPCR, yang memungkinkannya bertindak sebagai faktor pertukaran nukleotida guanin (Guanine nucleotide exchanger factor, GEF). GPCR kemudian dapat mengaktifkan protein G terkait dengan menukar GDP terikat ke protein G dengan GTP. Subunit protein Gα, bersama dengan GTP terikat, kemudian dapat dipisahkan dari subunit β dan γ untuk lebih lanjut memengaruhi protein pensinyalan intraseluler atau menargetkan protein fungsional secara langsung tergantung pada jenis subunit α Gαs, Gαi/o, Gαq/11, Gα12/13.[8]
GPCR merupakan target obat yang penting dan sekitar 34% [9] dari semua obat yang disetujui oleh FDA AS menargetkan 108 anggota famili ini. Volume penjualan global untuk obat-obatan ini diperkirakan 180 miliar dolar AS hingga tahun 2018.[9]
Sejarah dan signifikansi
suntingPenghargaan Nobel Kimia 2012 diberikan kepada Brian Kobilka dan Robert Lefkowitz untuk karya mereka yang "penting untuk memahami bagaimana fungsi reseptor terhubung protein G".[10] Setidaknya ada tujuh penghargaan Nobel lainnya yang diberikan untuk beberapa aspek pensinyalan yang dimediasi protein G. Pada 2012, dua dari sepuluh obat terlaris global (Advair Diskus dan Abilify) memiliki aksi dengan menargetkan reseptor terhubung protein G.[11]
Klasifikasi
suntingJumlah pasti dari superfamili GPCR tidak diketahui, tetapi setidaknya 810 gen manusia yang berbeda (atau ~ 4% dari seluruh genom penyandi protein) telah diprediksi menyandikan reseptor tersebut berdasarkan analisis urutan genom.[12][13] Meskipun banyak skema klasifikasi telah diusulkan, superfamili secara klasik dibagi menjadi tiga kelas utama (A, B, dan C) tanpa adanya kesamaan homologi urutan antar kelas.
Kelas terbesar sejauh ini adalah kelas A, yang menyumbang hampir 85% dari gen GPCR. Dari GPCR kelas A, lebih dari setengahnya diperkirakan menyandikan reseptor penciuman (reseptor olfactory), sedangkan sisanya diikat oleh senyawa endogen yang tidak diketahui jenis ligan pastinya atau diklasifikasikan sebagai reseptor orphan. Meskipun tidak adanya urutan homologi antara kelas, semua GPCR memiliki struktur dan mekanisme transduksi sinyal yang sama. Kelompok rhodopsin A yang sangat besar telah dibagi lagi menjadi 19 subkelompok (A1-A19).[14]
Baru-baru ini, sebuah sistem klasifikasi alternatif yang disebut GRAFS (Glutamat, Rhodopsin, Adhesi, Frizzled/Taste2, sekretin) telah diusulkan.[12] Menurut sistem A-F klasik, GPCR dapat dikelompokkan menjadi 6 kelas berdasarkan urutan homologi dan kesamaan fungsional:[15][16][17][18]
- Kelas A (atau 1) (Rhodopsin-like)
- Kelas B (atau 2) (Famili reseptor Secretin )
- Kelas C (atau 3) (Reseptor glutamat metabotropik/feromon)
- Kelas D (atau 4) (Reseptor feromon kawin jamur)
- Kelas E (atau 5) (Reseptor siklik AMP)
- Kelas F (atau 6) (Frizzled/Smoothened)
Sebuah studi awal berdasarkan urutan DNA yang tersedia menunjukkan bahwa genom manusia menyandi sekitar 750 GPCR,[19] sekitar 350 di antaranya mendeteksi hormon, faktor pertumbuhan, dan ligan endogen lainnya. Sekitar 150 GPCR yang ditemukan dalam genom manusia memiliki fungsi yang tidak diketahui.
Beberapa server web [20] dan metode prediksi bioinformatika [21][22] telah digunakan untuk memprediksi klasifikasi GPCR berdasarkan urutan asam aminonya, dengan menggunakan pendekatan komposisi asam amino semu.
Peran fisiologis
suntingGPCR terlibat dalam berbagai proses fisiologis. Beberapa contoh peran fisiologis mereka meliputi:
- Pengindraan visual: opsin, secara bertahap berevolusi dari GPCR awal lebih dari 650 juta tahun yang lalu, menggunakan reaksi fotoisomerisasi untuk menerjemahkan radiasi elektromagnetik menjadi sinyal seluler. Rhodopsin menggunakan konversi 11-cis -retinal menjadi all-trans -retinal untuk tujuan ini.
- Pengindraan gustatory (pengecap): GPCR dalam sel pengecap memediasi pelepasan gustducin dalam merespons senyawa pahit, zat umami, dan manis.
- Pengindraan penciuman: Reseptor penciuman mengikat epitel penciuman (reseptor penciuman) dan feromon (reseptor vomeronasal)
- Pengaturan perilaku dan suasana hati: Reseptor di otak mamalia mengikat beberapa neurotransmiter yang berbeda, termasuk serotonin, dopamin, GABA, dan glutamat
- Pengaturan aktivitas dan peradangan sistem imun: Reseptor kemokin mengikat ligan yang memerantarai komunikasi antar sel antara sel-sel sistem imun; reseptor seperti reseptor histamin mengikat mediator inflamasi dan melibatkan tipe sel target dalam respons inflamasi. GPCR juga terlibat dalam modulasi sistem imun dan secara langsung terlibat dalam penekanan respons imun yang diinduksi reseptor Toll-like (TLR) dari sel T.[23]
- Transmisi sistem saraf otonom: Baik sistem saraf simpatis dan parasimpatis diatur oleh jalur GPCR, bertanggung jawab untuk mengontrol banyak fungsi otomatis tubuh seperti tekanan darah, detak jantung, dan proses pencernaan.
- Pengindraan densitas sel: Peran GPCR baru dalam mengatur pengindraan densitas sel.
- Modulasi homeostasis (misalnya keseimbangan air).[24]
- Terlibat dalam pertumbuhan dan metastasis dari beberapa jenis tumor.[25]
- Digunakan dalam sistem endokrin untuk hormon turunan peptida dan asam amino yang mengikat GPCR pada membran sel sel target. Hal ini mengaktifkan cAMP, yang pada gilirannya mengaktifkan beberapa kinase, yang memungkinkan respons seluler seperti transkripsi.
Struktur reseptor
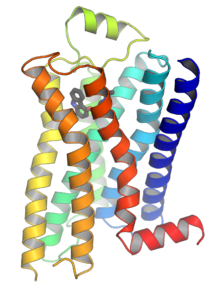
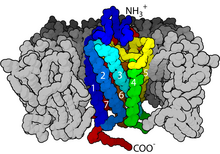
suntingGPCR adalah protein membran integral yang memiliki tujuh domain transmembran atau heliks transmembran.[26][27] Bagian ekstraseluler dari reseptor dapat diglikosilasi. Lengkung ekstraseluler ini juga mengandung dua residu sistein yang sangat lestari yang membentuk ikatan disulfida untuk menstabilkan struktur reseptor. Beberapa protein transmembran heliks tujuh (kanal rhodopsin) yang menyerupai GPCR mungkin mengandung kanal ion di dalam proteinnya.
Pada tahun 2000, struktur kristal pertama dari GPCR mamalia yaitu rhodopsin sapi (1F88) telah terpecahkan.[28] Pada tahun 2007, struktur pertama dari GPCR manusia dipecahkan [1][29][30] yaitu reseptor β2-adrenergik yang memiliki struktur sangat mirip dengan rhodopsin sapi. Struktur GPCR yang diaktifkan atau terikat agonis juga telah ditentukan.[31][32][33][34] Struktur-struktur ini menunjukkan bagaimana ikatan ligan pada sisi ekstraseluler suatu reseptor mengarah pada perubahan konformasi pada sisi sitoplasma reseptor. Perubahan terbesar adalah pergerakan ke luar dari bagian sitoplasma dari heliks transmembran 5 dan 6 (TM5 dan TM6). Struktur reseptor β2-adrenergik aktif membentuk kompleks dengan Gs menegaskan bahwa Gα mengikat rongga yang diciptakan oleh gerakan ini.[35]
GPCR secara evolusioner terkait dengan beberapa protein lain dengan domain transmembran 7, seperti rhodopsin mikrob dan reseptor adiponektin 1 dan 2 (ADIPOR1 dan ADIPOR2). Namun, reseptor dan kanal 7TMH ini tidak bergandengan dengan protein G. Selain itu, ADIPOR1 dan ADIPOR2 berorientasi berlawanan dengan GPCR di membran (yaitu GPCR biasanya memiliki ujung N pada ekstraseluler, ujung C di sitoplasma, sedangkan ADIPOR terbalik).[36]
Hubungan struktur dan fungsi
suntingDalam hal struktur, GPCR dicirikan oleh ujung N ekstraseluler, diikuti oleh tujuh transmembran (7-TM) α-heliks (TM-1 hingga TM-7) yang dihubungkan oleh tiga lengkung intraseluler (IL-1 hingga IL-3) dan tiga lengkung ekstraseluler (EL-1 hingga EL-3), dan akhirnya ujung C intraseluler. GPCR mengatur dirinya sendiri menjadi struktur tersier yang menyerupai barel, dengan tujuh heliks transmembran membentuk rongga di dalam membran plasma yang melayani domain pengikat ligan yang sering dicakup oleh EL-2. Ligan juga dapat mengikat di tempat lain, seperti halnya ligan meruah (misalnya protein atau peptida besar), yang berinteraksi dengan lengkung ekstraseluler, atau seperti diilustrasikan oleh reseptor metabotropik glutamat kelas C (mGluRs) berikatan pada ekor ujung N. GPCR kelas C dibedakan oleh ekor ujung N yang besar, yang juga mengandung domain pengikat ligan. Setelah mengikat glutamat ke mGluR, ekor ujung N mengalami perubahan konformasi yang mengarah pada interaksinya dengan residu lengkung ekstraseluler dan domain TM. Efek akhirnya dari ketiga jenis aktivasi yang diinduksi agonis yaitu perubahan orientasi relatif heliks TM (disamakan dengan gerakan memutar) yang mengarah ke permukaan intraseluler yang lebih luas dan "pembukaan" residu dari heliks intraseluler dan domain penting TM untuk menandai fungsi transduksi (yaitu kopling protein G). Agonis terbalik dan antagonis juga dapat berikatan dengan sejumlah situs yang berbeda, tetapi efek akhirnya yaitu pencegahan reorientasi heliks TM ini.[2]
Struktur ekor ujung N dan C GPCRs juga dapat berfungsi penting di luar pengikatan ligan. Contohnya, ujung C dari reseptor muskarinik M3 cukup, dan enam asam amino polibasa (KKKRRK) domain di ujung C diperlukan untuk pre-penyusunan dengan protein Gq.[37] Secara khusus, ujung C sering mengandung residu serin (Ser) atau treonin (Thr) yang, ketika difosforilasi, meningkatkan afinitas permukaan intraseluler untuk pengikatan protein perancah yang disebut β-arrestin (β-arr).[38] Setelah terikat, β-arrestin keduanya secara sterik mencegah berikatan dengan protein G dan dapat merekrut protein lain, yang mengarah pada pembentukan kompleks pensinyalan yang terlibat dalam aktivasi jalur sinyal-sinyal kinase (ERK) ekstraseluler yang diatur atau reseptor endositosis (internalisasi). Karena fosforilasi residu Ser dan Thr ini sering terjadi sebagai akibat dari aktivasi GPCR, pelepasan protein G dimediasi β-arrestin, dan internalisasi GPCR adalah mekanisme penting desensitisasi.[39] Selain itu, "mega-kompleks" yang diinternalisasi terdiri dari GPCR tunggal, β-arrestin (dalam konformasi ekor),[40][41] dan protein G heterotrimerik ada dan dapat menjelaskan pensinyalan protein dari endosom.[42]
Tema struktural umum terakhir di antara GPCR adalah palmitoilasi dari satu atau lebih situs dari ujung C atau lengkung intraseluler. Palmitoilasi adalah modifikasi kovalen residu sistein (Cys) melalui penambahan gugus asil hidrofobik, dan memiliki efek menargetkan reseptor terhadap mikrodomain kaya kolesterol dan sfingolipid dari membran plasma yang disebut rakit lipid. Karena banyak molekul transduser hilir dan efektor GPCR (termasuk yang terlibat dalam jalur umpan balik negatif) juga ditargetkan untuk rakit lipid, hal ini memiliki efek memfasilitasi pensinyalan reseptor cepat.
GPCR merespons sinyal ekstraseluler yang dimediasi oleh beragam agonis, mulai dari protein hingga amina biogenik hingga proton, tetapi semua mentransduksi sinyal ini melalui mekanisme penggandengan protein G. Hal ini dimungkinkan oleh domain guanine -nucleotide exchange factor (GEF) yang utamanya dibentuk oleh kombinasi IL-2 dan IL-3 bersama dengan residu berdekatan dari heliks TM terkait.
Mekanisme
suntingReseptor terhubung protein G diaktifkan oleh sinyal eksternal dalam bentuk ligan atau mediator sinyal lainnya. Hal ini menciptakan perubahan konformasi pada reseptor, menyebabkan aktivasi protein G. Efek lebih lanjut tergantung pada jenis protein G. Protein G kemudian dinonaktifkan oleh protein pengaktif GTPase, yang dikenal sebagai protein RGS.
Ikatan ligan
suntingGPCR meliputi satu atau lebih reseptor untuk ligan berikut: mediator sinyal sensorik (misalnya, molekul stimulasi cahaya dan penciuman); adenosin, bombesin, bradikinin, endotelin, asam γ-aminobutirat (GABA), faktor pertumbuhan hepatosit (HGF), melanokortin, neuropeptida Y, peptida opioid, opsins, somatostatin, GH, tachykinin, anggota vasoaktif, anggota famili dan vasopeptida; amina biogenik (misalnya dopamin, epinefrin norepinefrin, histamin, serotonin, dan melatonin); glutamat (efek metabotropik); glukagon; asetilkolin (efek muskarinik); kemokin; mediator lipid dari peradangan (misalnya, prostaglandin, prostanoid, faktor pengaktif trombosit, dan leukotrien); hormon peptida (misalnya, kalsitonin, C5a Anafilatoksin, follicle-stimulating hormone [ FSH], gonadotropin-releasing hormone [GnRH], neurokinin, tiroliberin [TRH], dan oksitosin); dan endocannabinoid.
GPCR yang bertindak sebagai reseptor untuk rangsangan yang belum diidentifikasi dikenal sebagai reseptor orphan.
Namun, dalam jenis reseptor lain yang telah dipelajari, di mana ligan mengikat secara eksternal ke membran, ligan GPCR biasanya mengikat dalam domain transmembran. Namun, reseptor yang diaktifkan protease diaktifkan oleh pembelahan bagian dari domain ekstraseluler mereka.[44]
Perubahan konformasi
suntingTransduksi sinyal melalui membran oleh reseptor tidak sepenuhnya dipahami. Diketahui bahwa dalam keadaan tidak aktif, GPCR terikat pada kompleks protein G heterotrimerik. Pengikatan agonis dengan GPCR menghasilkan perubahan konformasi pada reseptor yang ditransmisikan ke subunit Gα terikat dari protein G heterotrimerik melalui dinamika domain protein. Subunit Gα yang diaktifkan menukar GTP menggantikan GDP yang pada gilirannya memicu disosiasi subunit Gα dari dimer Gγ dan dari reseptor. Subunit G α dan Gβγ terdisosiasi berinteraksi dengan protein intraseluler lainnya untuk melanjutkan kaskade transduksi sinyal sementara GPCR yang dibebaskan dapat berevolusi menjadi protein G heterotrimerik lain untuk membentuk kompleks baru yang siap untuk memulai putaran transduksi sinyal lainnya.[45]
Diyakini bahwa molekul reseptor ada dalam kesetimbangan konformasi antara keadaan biofisik aktif dan tidak aktif.[46] Pengikatan ligan dengan reseptor dapat menggeser kesetimbangan menuju keadaan reseptor aktif. Ada tiga jenis ligan: Agonis adalah ligan yang menggeser keseimbangan demi keadaan aktif; agonis terbalik adalah ligan yang menggeser kesetimbangan untuk keadaan tidak aktif; dan antagonis netral adalah ligan yang tidak memengaruhi kesetimbangan. Belum diketahui bagaimana sebenarnya keadaan aktif dan tidak aktif berbeda satu sama lain.
Siklus aktivasi dan deaktivasi protein G
suntingKetika reseptor tidak aktif, domain GEF mungkin terikat pada subunit α yang tidak aktif dari protein G heterotrimerik. Protein G ini adalah trimer dari subunit α, β, dan γ (masing-masing dikenal sebagai Gα, Gβ, dan Gγ) yang dibuat tidak aktif ketika secara reversibel terikat dengan Guanosine diphosphate (GDP) (atau kemungkinan lain, tanpa nukleotida guanin) tetapi aktif ketika terikat dengan guanosine trifosfat (GTP). Pada saat aktivasi reseptor, domain GEF, pada gilirannya, secara alosterik mengaktifkan protein G dengan memfasilitasi pertukaran molekul GDP untuk GTP di subunit α dari protein G. Sel mempertahankan rasio 10: 1 dari GTP sitosolik:GDP sehingga pertukaran untuk GTP terjamin. Pada titik ini, subunit dari protein G berdisosiasi dari reseptor, serta satu sama lain, untuk menghasilkan monomer Gα-GTP dan dimer Gβγ yang berinteraksi erat, yang sekarang bebas untuk memodulasi aktivitas protein intraseluler lainnya. Sejauh mana mereka dapat berdifusi, bagaimanapun, terbatas karena palmitoilasi Gα dan adanya gugus isoprenoid yang secara kovalen ditambahkan ke ujung C Gγ.
Karena Gα juga memiliki kemampuan hidrolisis GTP → GDP yang lambat, bentuk subunit α (Gα-GDP) yang tidak aktif pada akhirnya diregenerasi, sehingga memungkinkan pengikatan kembali dengan dimer Gβ form untuk membentuk protein G "istirahat", yang dapat kembali mengikat ke GPCR dan menunggu aktivasi. Tingkat hidrolisis GTP sering dipercepat karena aksi famili lain dari protein modulasi allosterik yang disebut Regulator G-protein Signaling (protein RGS), yang merupakan jenis GTPase-Activatng Protein (GAP). Sebenarnya, banyak protein efektor utama (misal adenilil siklase) yang menjadi aktif/tidak aktif saat berinteraksi dengan Gα-GTP juga memiliki aktivitas GAP. Dengan demikian, bahkan pada tahap awal dalam proses ini, pensinyalan yang diprakarsai GPCR memiliki kapasitas untuk penghentian diri.
Interaksi silang
suntingSinyal hilir GPCR telah terbukti mungkin berinteraksi dengan sinyal integrin, seperti FAK.[47] Pensinyalan integrin akan memfosforilasi FAK, yang kemudian dapat mengurangi aktivitas GPCR Gαα.
Pensinyalan
suntingJika reseptor dalam keadaan aktif menemukan protein G, ia dapat mengaktifkannya. Beberapa bukti menunjukkan bahwa reseptor dan protein G sebenarnya sudah digabungkan sebelumnya.[37] Sebagai contoh, pengikatan protein G ke reseptor mempengaruhi afinitas reseptor untuk ligan. Protein G teraktivasi terikat dengan GTP.
Transduksi sinyal lebih lanjut tergantung pada jenis protein G. Enzim adenilil siklase adalah contoh protein seluler yang dapat diatur oleh protein G, dalam hal ini protein Gs. Aktivitas adenilil siklase diaktifkan ketika ia berikatan dengan subunit dari protein G yang diaktifkan. Aktivasi adenilil siklase berakhir ketika protein G kembali ke keadaan terikat-GDP.
Adenilil siklase juga dapat diaktifkan atau dihambat dengan cara lain (misalnya mengikat Ca2+/calmodulin), yang dapat memodifikasi aktivitas enzim ini secara aditif atau sinergis bersama dengan protein G.
Jalur pensinyalan yang diaktifkan melalui GPCR dibatasi oleh urutan primer dan struktur tersier dari GPCR itu sendiri tetapi pada akhirnya ditentukan oleh konformasi tertentu yang distabilkan oleh ligan tertentu, serta ketersediaan molekul transduser. Saat ini, GPCR dianggap menggunakan dua jenis transduser utama: protein G dan β-arrestin. Karena β-arrestin memiliki afinitas tinggi hanya terhadap bentuk terfosforilasi dari sebagian besar GPCR (lihat di atas atau di bawah), sebagian besar pensinyalan pada akhirnya tergantung pada aktivasi protein G. Namun, kemungkinan interaksi memang memungkinkan terjadinya pensinyalan tidak bergantung protein G.
Pensinyalan yang bergantung pada protein G
suntingAda tiga jalur pensinyalan yang dimediasi protein G, yang diperantarai oleh empat sub-kelas protein G yang dibedakan satu sama lain dengan urutan homologi (Gαs, Gαi/o, Gαq/11, dan Gα12/13). Setiap subkelas protein G terdiri dari beberapa protein, masing-masing produk dari beberapa gen atau variasi sambatan yang mungkin mengilhami mereka dengan perbedaan mulai dari yang halus hingga yang berbeda berkaitan dengan sifat pensinyalan, tetapi secara umum mereka tampak dikelompokkan ke dalam empat kelas. Karena sifat transduksi sinyal dari berbagai kemungkinan kombinasi βγ tidak tampak berbeda secara radikal satu sama lain, kelas-kelas ini didefinisikan sesuai dengan isoform subunit α mereka.[8]
Sementara sebagian besar GPCR mampu mengaktifkan lebih dari satu subtipe Gα, mereka juga menunjukkan preferensi untuk satu subtipe daripada subtipe lain. Ketika subtipe yang diaktifkan tergantung pada ligan yang terikat pada GPCR, ini disebut selektivitas fungsional (juga dikenal sebagai pengangkutan yang diarahkan agonis, atau agonisme konformasi-spesifik). Namun, pengikatan agonis tunggal mana pun juga dapat memulai aktivasi beberapa protein G yang berbeda, karena mungkin mampu menstabilkan lebih dari satu konformasi domain GEF GPCR, bahkan selama interaksi tunggal. Selain itu, konformasi yang lebih disukai mengaktifkan satu isoform dari Gα dapat mengaktifkan yang lain jika yang lebih disukai kurang tersedia. Selanjutnya, jalur umpan balik dapat menghasilkan modifikasi reseptor (misalnya, fosforilasi) yang mengubah preferensi protein G. Terlepas dari berbagai nuansa ini, pasangan penggandeng pilihan GPCR biasanya ditentukan berdasarkan protein G yang paling jelas diaktifkan oleh ligan endogen di bawah sebagian besar kondisi fisiologis atau eksperimental.
Pensinyalan Gα
sunting- Efektor dari jalur Gαs dan Gαi/o adalah siklik-adenosin monofosfat (cAMP) yang menghasilkan enzim adenilil siklase. Walaupun ada sepuluh produk gen adenilil siklase berbeda pada mamalia, masing-masing dengan perbedaan tipis dalam distribusi atau fungsi jaringan, semuanya mengkatalisasi konversi sitosol adenosin trifosfat (ATP) menjadi cAMP, dan semuanya secara langsung distimulasi oleh protein G dari kelas Gα. Sebaliknya, interaksi dengan subunit Gα dari tipe Gαi/o menghambat AC dari menghasilkan cAMP. Dengan demikian, GPCR yang digabungkan ke Gα melawan aksi GPCR yang digabungkan ke Gαi/o, dan sebaliknya. Tingkat cAMP sitosolik kemudian dapat menentukan aktivitas berbagai kanal ion serta anggotaprotein kinase A spesifik ser/Thr (PKA). Dengan demikian cAMP dianggap sebagai pembawa pesan kedua dan PKA sebagai efektor sekunder.
- Efektor dari jalur Gαq/11 adalah fosfolipase C-β (PLCβ), yang mengkatalisis pembelahan membran fosfatidlinositol 4,5-bifosfat (PIP2) yang terikat membran ke dalam pembawa pesan kedua inositol (1,4,5) trifosfat (IP3) ) dan diasilgliserol (DAG). IP3 bekerja pada reseptor IP3 yang ditemukan dalam membran retikulum endoplasma (ER) untuk memperoleh pelepasan Ca2+ dari ER, sementara DAG berdifusi di sepanjang membran plasma di mana ia dapat mengaktifkan segala bentuk terlokalisasi dari ser/thr kinase kedua yang disebut protein kinase C (PKC). Karena banyak isoform dari PKC juga diaktifkan oleh peningkatan Ca2+ intraseluler, kedua jalur ini juga dapat bertemu satu sama lain untuk memberi sinyal melalui efektor sekunder yang sama. Ca2+ intraseluler yang meningkat juga mengikat dan secara allosteris mengaktifkan protein yang disebut calmodulin, yang selanjutnya mengikat dan mengaktifkan enzim secara allosterik seperti Ca2+/kinase yang bergantung pada calmodulin (CAMK).
- Efektor dari jalur Gα12/13 adalah tiga RhoGEF (p115-RhoGEF, PDZ-RhoGEF, dan LARG), yang ketika terikat dengan Gα12/13 secara alosterik mengaktifkan GTPase kecil sitosolik, Rho. Setelah terikat dengan GTP, Rho kemudian dapat mengaktifkan berbagai protein yang bertanggung jawab untuk regulasi sitoskeleton seperti Rho-kinase (ROCK). Sebagian besar GPCR yang berpasangan dengan Gα12/13 juga berpasangan dengan subkelas lainnya, sering kali Gαq/11.
Pensinyalan Gβγ
suntingPensinyalan Gβγ juga merupakan pensinyalan yang penting, khususnya dalam kasus GPCR dengan subunit G αi / o. Efektor utama Gβγ adalah berbagai kanal ion, seperti kanal K+ GIRK (G-protein-regulated inwardly rectifying K+ channels) kanal Ca2+ terkait tegangan tipe N dan P/Q, serta beberapa isoform dari adenilil siklase dan PLC, bersama dengan beberapa isoform phosphoinositide-3-kinase (PI3K).
Pensinyalan tidak bergantung protein G
suntingMeskipun secara klasik dianggap hanya bekerja bersama, GPCR dapat memberi sinyal melalui mekanisme tidak bergantung protein G, dan protein G heterotrimerik dapat memainkan peran fungsional independen dari GPCR. GPCR dapat memberi sinyal secara independen melalui banyak protein seperti β-arrestin, GRK, dan Src. Pensinyalan tersebut telah terbukti relevan secara fisiologis, misalnya pensinyalan β-arrestin yang dimediasi oleh reseptor kemokin CXCR3 diperlukan untuk kemotaksis sel T teraktivasi.[48] Selain itu, reseptor yang terlibat dalam lokalisasi subselular GPCR (misalnya protein yang mengandung domain PDZ) juga dapat bertindak sebagai transduser sinyal. Efektor paling sering yaitu anggota famili MAPK.
Pada akhir 1990-an, akumulasi bukti menunjukkan bahwa beberapa GPCR mampu memberi sinyal tanpa protein G. Protein kinase yang diaktifkan mitogen ERK2, mediator transduksi sinyal kunci di hilir aktivasi reseptor di banyak jalur, telah terbukti diaktifkan sebagai respons terhadap aktivasi reseptor yang dimediasi cAMP dalam jamur lendir D. discoideum meskipun tidak ada protein subunit α dan β protein G.[49]
Pada sel mamalia, adrenoseptor β2 yang banyak dipelajari telah ditunjukkan untuk mengaktifkan jalur ERK2 setelah pelepasan dimediasi arrestin dari sinyal yang diperantarai protein G. Oleh karena itu, tampaknya beberapa mekanisme yang sebelumnya diyakini terkait murni dengan desensitisasi reseptor sebenarnya adalah contoh dari reseptor yang mengubah jalur pensinyalan, daripada hanya dimatikan.
Pada sel-sel ginjal, reseptor bradikinin B2 telah terbukti berinteraksi langsung dengan protein tirosin fosfatase. Adanya urutan ITIM (immunoreceptor tyrosine-based inhibitory motif) terfosforilasi pada tirosin dalam reseptor B2 diperlukan untuk memediasi interaksi ini dan selanjutnya efek antiproliferatif bradikinin.[50]
Pensinyalan tidak bergantung GPCR oleh protein G heterotrimerik
suntingMeskipun area penelitian ini relatif belum matang, tampaknya protein G heterotrimerik juga dapat mengambil bagian dalam pensinyalan non-GPCR. Terdapat bukti untuk peran sebagai transduser sinyal di hampir semua jenis pensinyalan yang dimediasi reseptor, termasuk integrin, reseptor tirosin kinase (RTK), reseptor sitokin (JAK/STAT), serta modulasi berbagai protein "aksesori" lain seperti GEF, inhibitor disosiasi guanine-nukleotida (GDI), dan protein fosfatase. Bahkan mungkin ada protein spesifik dari kelas-kelas ini yang fungsi utamanya adalah sebagai bagian dari jalur tidak bergantung GPCR, disebut aktivator pensinyalan protein G (activators of G-protein signaling, AGS). Interaksi ini dan pentingnya Gα vs subunit Gβγ untuk proses ini masih belum jelas.
Detail jalur cAMP dan PIP2
suntingAda dua jalur transduksi sinyal utama yang melibatkan reseptor terkait protein G: jalur sinyal cAMP dan jalur sinyal fosfatidilinositol .[7]
Jalur sinyal cAMP
suntingTransduksi sinyal cAMP mengandung 5 karakter utama: reseptor hormon stimulatif (Rs) atau reseptor hormon penghambat (Ri); stimulasi protein G stimulatif (Gs) atau protein G inhibitory (Gi); adenilil siklase; protein kinase A (PKA); dan cAMP fosfodiesterase.
Stimulative hormone receptor (Rs) adalah reseptor yang dapat mengikat dengan molekul sinyal stimulatif, sedangkan reseptor hormon penghambat (Ri) adalah reseptor yang dapat mengikat dengan molekul sinyal penghambat.
Stimulatif regulatif protein G adalah protein G yang dihubungkan dengan reseptor hormon stimulatif (Rs), dan subunit α-nya saat aktivasi dapat merangsang aktivitas enzim atau metabolisme intraseluler lainnya. Sebaliknya, inhibitor protein G regulatori terkait dengan reseptor hormon penghambat, dan subunit α pada saat aktivasi dapat menghambat aktivitas enzim atau metabolisme intraseluler lainnya.
Adenilil siklase adalah glikoprotein 12-transmembran yang mengkatalisasi ATP untuk membentuk cAMP dengan bantuan kofaktor Mg2+ atau Mn2+. cAMP yang dihasilkan yaitu pembawa pesan kedua dalam metabolisme seluler dan merupakan penggerak allosterik protein kinase A.
Protein kinase A (PKA) adalah enzim penting dalam metabolisme sel karena kemampuannya untuk mengatur metabolisme sel dengan memfosforilasi enzim spesifik yang dilakukan dalam jalur metabolisme. PKA juga dapat mengatur ekspresi gen spesifik, sekresi seluler, dan permeabilitas membran. PKA mengandung dua subunit katalitik dan dua subunit pengatur. Ketika tidak ada cAMP, kompleksnya tidak aktif. Ketika cAMP mengikat subunit pengatur, konformasi mereka diubah, menyebabkan disosiasi subunit pengatur, yang mengaktifkan PKA dan memungkinkan efek biologis lebih lanjut.
Sinyal-sinyal ini kemudian dapat diakhiri dengan cAMP fosfodiesterase, yang merupakan enzim yang mendegradasi cAMP menjadi 5'-AMP dan menonaktifkan protein kinase A.
Jalur sinyal fosfatidlinositol
suntingDalam jalur sinyal fosfatidilinositol, molekul sinyal ekstraseluler berikatan dengan GPCR (Gq) pada permukaan sel dan mengaktifkan fosfolipase C, yang terletak di membran plasma. Lipase menghidrolisis fosfatidlinositol 4,5-bifosfat (PIP2) menjadi dua pembawa pesan kedua: inositol 1,4,5-trifosfat (IP3) dan diasilgliserol (DAG). IP3 berikatan dengan reseptor IP3 di membran retikulum endoplasma halus dan mitokondria untuk membuka kanal Ca2+. DAG membantu mengaktifkan protein kinase C (PKC), yang memfosforilasi banyak protein lain, mengubah aktivitas katalitiknya, yang mengarah ke respons seluler.
Efek Ca 2+ juga luar biasa: bekerja sama dengan DAG dalam mengaktifkan PKC dan dapat mengaktifkan jalur CaM kinase, di mana kalsium mododulasi protein calmodulin (CaM) mengikat Ca2+, mengalami perubahan konformasi, dan mengaktifkan CaM kinase II, yang memiliki kemampuan unik untuk meningkatkan afinitas pengikatannya pada CaM dengan autofosforilasi, membuat CaM tidak tersedia untuk aktivasi enzim lain. Kinase kemudian memfosforilasi enzim target, mengatur aktivitas mereka. Kedua jalur sinyal dihubungkan bersama oleh Ca2+-CaM, yang juga merupakan subunit pengatur dari adenlil siklase dan phosphodiesterase di jalur sinyal cAMP.
Pengaturan reseptor
suntingGPCR menjadi tidak peka ketika terkena ligan mereka untuk jangka waktu yang lama. Ada dua bentuk desensitisasi yang dikenal yaitu: 1) desensitisasi homolog, di mana GPCR yang diaktifkan diatur ke bawah; dan 2) desensitisasi heterolog, di mana GPCR yang diaktifkan menyebabkan downregulasi GPCR yang berbeda. Reaksi kunci dari downregulasi ini adalah fosforilasi dari domain reseptor intraseluler (atau sitoplasma) oleh protein kinase.
Fosforilasi oleh protein kinase tergantung-cAMP
suntingKinase protein AMP yang bergantung pada AMP (protein kinase A) diaktifkan oleh rantai sinyal yang berasal dari protein G (yang telah diaktifkan oleh reseptor) melalui adenilil siklase dan siklik AMP (cAMP). Dalam mekanisme umpan balik, kinase yang diaktifkan ini memfosforilasi reseptor. Semakin lama reseptor tetap aktif, semakin banyak kinase diaktifkan dan semakin banyak reseptor terfosforilasi. Dalam ß2-adrenoseptor, fosforilasi ini hasil dalam pengalihan kopling dari kelas Gs dari protein G ke kelas Gi.[51] Fosforilasi yang dimediasi oleh PKA yang bergantung pada cAMP dapat menyebabkan desensitisasi heterolog pada reseptor selain yang diaktifkan.[52]
Fosforilasi oleh GRK
suntingG-reseptor protein-coupled G (GRK) adalah protein kinase yang memfosforilasi hanya GPCR aktif.[53] G-protein-coupled receptor kinase (GRK) adalah modulator kunci pensinyalan GPCR. Mereka membentuk famili dari tujuh protein kinase serin-treonin mamalia yang memfosforilasi reseptor agonis-terikat. Fosforilasi reseptor yang dimediasi GRK dengan cepat memicu penurunan yang sangat besar pada pensinyalan dan desensisasi reseptor. Aktivitas GRK dan penargetan subseluler diatur dengan ketat oleh interaksi dengan domain reseptor, subunit protein G, lipid, protein penahan dan protein yang peka kalsium.[54]
Fosforilasi reseptor dapat memiliki dua konsekuensi:
- Translokasi: Reseptor bersama dengan bagian dari membran yang tertanam di dalamnya, dibawa ke bagian dalam sel, tempat ia terdefosforilasi dalam lingkungan vesikel asam [55] dan kemudian dibawa kembali. Mekanisme ini digunakan untuk mengatur paparan jangka panjang, misalnya terhadap hormon, dengan memungkinkan resensitisasi mengikuti desensitisasi. Atau, reseptor dapat mengalami degradasi lisozom, atau tetap diinternalisasi, di mana ia diperkirakan berpartisipasi dalam inisiasi peristiwa pensinyalan, yang sifatnya tergantung pada lokalisasi subselular vesikel yang diinternalisasi.[52]
- Terhubung arrestin: Reseptor terfosforilasi dapat dihubungkan dengan arrestin yang mencegah dari mengikat (dan mengaktifkan) protein G, pada dasarnya mematikan itu untuk waktu singkat. Mekanisme ini digunakan, misalnya oleh rhodopsin dalam sel retina untuk mengkompensasi paparan cahaya terang. Dalam banyak kasus, pengikatan arrestin pada reseptor adalah prasyarat untuk translokasi. Sebagai contoh, beta-arrestin terikat adrenoreseptor ß2 bertindak sebagai adaptor untuk mengikat dengan clathrin, dan dengan beta-subunit dari AP2 (molekul adaptor clathrin); dengan demikian, arrestin di sini bertindak sebagai perancah perakitan komponen yang diperlukan untuk endositosis dimediasi clathrin dari adrenoreseptor β2.[56][57]
Mekanisme pemutusan sinyal GPCR
suntingSeperti disebutkan di atas, protein G dapat menghentikan aktivasi mereka sendiri karena GTP intrinsik mereka → kemampuan hidrolisis GDP. Namun, reaksi ini berlangsung pada kecepatan lambat (≈2,0 kali / detik) dan, oleh karena itu, dibutuhkan sekitar 50 detik untuk setiap protein G tunggal untuk dinonaktifkan jika faktor-faktor lain tidak ikut berperan. Memang, ada sekitar 30 isoform protein RGS yang, ketika terikat ke Gα melalui domain GAP mereka, mempercepat laju hidrolisis menjadi ≈30 kali / detik. Peningkatan kecepatan 1500 kali lipat ini memungkinkan sel untuk merespons sinyal eksternal dengan kecepatan tinggi, serta resolusi spasial karena jumlah messenger kedua yang terbatas yang dapat dihasilkan dan jarak terbatas protein G dapat berdifusi dalam 0,03 detik. Untuk sebagian besar, protein RGS adalah promiscuous dalam kemampuan mereka untuk mengaktifkan protein G, sedangkan RGS yang terlibat dalam jalur pensinyalan yang diberikan tampaknya lebih ditentukan oleh jaringan dan GPCR yang terlibat daripada yang lainnya. Selain itu, protein RGS memiliki fungsi tambahan untuk meningkatkan tingkat pertukaran GTP-GDP di GPCR (sebagai semacam co-GEF) yang selanjutnya berkontribusi pada resolusi waktu pensinyalan GPCR.
Selain itu, GPCR mungkin tidak sensitif terhadap dirinya sendiri. Ini dapat terjadi sebagai:
- akibat langsung dari pendudukan ligan, di mana perubahan konformasi memungkinkan perekrutan Kinase Pengatur GPCR (GRK), yang berlanjut ke fosforilasi berbagai residu serin / treonin IL-3 dan ekor ujung C. Setelah fosforilasi GRK, afinitas GPCR untuk β-arrestin (β-arrestin-1/2 di sebagian besar jaringan) meningkat, di mana titik β-arrestin dapat mengikat dan bertindak untuk keduanya secara sterik menghambat pengikatan protein G serta memulai proses internalisasi reseptor melalui endositosis yang dimediasi clathrin. Karena hanya reseptor ligan yang mengalami desensitisasi oleh mekanisme ini, maka disebut desensitisasi homolog
- afinitas untuk β-arrestin dapat ditingkatkan dalam pekerjaan ligan dan cara yang tidak bergantung GRK melalui fosforilasi berbagai lokasi layanan (tetapi juga IL-3 dan ekor ujung C) oleh PKC dan PKA. Fosforilasi ini sering kali cukup untuk merusak kopling protein G sendiri.
- PKC/PKA dapat memfosforilasi GRK yang juga dapat menyebabkan fosforilasi GPCR dan pengikatan β-arrestin dalam cara yang tidak tergantung pada pekerjaan. Dua mekanisme terakhir ini memungkinkan terjadinya desensitisasi terhadap satu GPCR karena aktivitas yang lain, atau desensitisasi heterolog. GRK mungkin juga memiliki domain GAP dan karenanya dapat berkontribusi untuk inaktivasi melalui mekanisme non-kinase juga. Kombinasi dari mekanisme ini juga dapat terjadi.
Setelah β-arrestin terikat ke GPCR, ia mengalami perubahan konformasi yang memungkinkannya untuk berfungsi sebagai protein perancah untuk kompleks adaptor yang disebut AP-2, yang pada gilirannya merekrut protein lain yang disebut clathrin. Jika cukup reseptor di daerah setempat merekrut clathrin dengan cara ini, mereka agregat dan membran tunas ke dalam sebagai akibat interaksi antara molekul-molekul clathrin, dalam proses yang disebut opsonisasi. Setelah lubang telah dijepit dari membran plasma karena aksi dua protein lain yang disebut amphiphysin dan dynamin, sekarang menjadi vesikel endositik. Pada titik ini, molekul adaptor dan clathrin telah berdisosiasi, dan reseptornya diperdagangkan kembali ke membran plasma atau ditargetkan ke lisosom untuk degradasi.
Pada titik mana pun dalam proses ini, β-arrestin juga dapat merekrut protein lain — seperti tirosin kinase non-reseptor (nRTK), c-SRC — yang dapat mengaktifkan ERK1/2, atau pensinyalan protein kinase teraktivasi mitogen lainnya (MAPK) misalnya melalui fosforilasi GTPase kecil, Ras, atau merekrut protein dari kaskade ERK secara langsung (yaitu Raf-1, MEK, ERK-1/2) di mana pensinyalan titik dimulai karena kedekatannya dengan satu sama lain. Target lain dari c-SRC adalah molekul dinamin yang terlibat dalam endositosis. Dinamin mempolimerisasi di sekitar leher vesikel yang masuk, dan fosforilasi oleh c-SRC memberikan energi yang diperlukan untuk perubahan konformasi yang memungkinkan "penjepit" terakhir dari membran.
Pengaturan seluler GPCR
suntingDesensitisasi reseptor dimediasi melalui kombinasi fosforilasi, pengikatan β-arrestin, dan endositosis seperti dijelaskan di atas. Penurunan terjadi ketika reseptor endositosis tertanam dalam endosom yang diperdagangkan untuk bergabung dengan organel yang disebut lisosom. Karena membran lisosom kaya akan pompa proton, interiornya memiliki pH rendah (-4,8 vs pH -2,2 sitosol), yang bertindak untuk mendenaturasi GPCR. Selain itu, lisosom mengandung banyak enzim degradatif, termasuk protease, yang hanya dapat berfungsi pada pH rendah, sehingga ikatan peptida yang bergabung dengan residu GPCR bersama-sama dapat dibelah. Apakah reseptor yang diberikan diperdagangkan ke lisosom, ditahan dalam endosom, atau diangkut kembali ke membran plasma tergantung pada berbagai faktor, termasuk jenis reseptor dan besarnya sinyal. Regulasi GPCR juga dimediasi oleh faktor transkripsi gen. Faktor-faktor ini dapat meningkatkan atau mengurangi transkripsi gen dan dengan demikian meningkatkan atau mengurangi generasi reseptor baru (naik atau turunnya regulasi) yang berjalan ke membran sel.
Oligomisasi reseptor
suntingOligomerisasi GPCR adalah fenomena luas. Salah satu contoh yang paling banyak dipelajari adalah reseptor GABAB metabotropik. Reseptor konstitutif yang disebut ini dibentuk oleh heterodimerisasi subunit GABABR1 dan GABABR2. Ekspresi GABABR1 tanpa GABABR2 dalam sistem heterolog mengarah pada retensi subunit di retikulum endoplasma. Ekspresi dari subunit GABABR2 saja, sementara itu, mengarah pada ekspresi permukaan subunit, meskipun tanpa aktivitas fungsional (yaitu reseptor tidak mengikat agonis dan tidak dapat memulai respons setelah paparan agonis). Ekspresi dari dua subunit bersama menyebabkan ekspresi membran plasma reseptor fungsional. Telah ditunjukkan bahwa pengikatan GABABR2 ke GABABR1 menyebabkan penutupan sinyal retensi [58] dari reseptor fungsional.[59]
Asal dan diversifikasi superfamili
suntingTransduksi sinyal dimediasi oleh superfamili GPCRs kembali ke asal multiseluleritas. GPCR serupa mamalia ditemukan dalam jamur, dan telah diklasifikasikan menurut sistem klasifikasi GRAFS berdasarkan sidik jari GPCR.[60] Identifikasi anggota superfamili di domain eukariota, dan perbandingan motif khusus famili, telah menunjukkan bahwa superfamili GPCR memiliki asal yang sama.[61] Motif karakteristik menunjukkan bahwa tiga dari lima famili GRAFS, Rhodopsin, Adhesi, dan Frizzled, berevolusi dari reseptor cAMP Dictyostelium discoideum sebelum pemisahan Opisthokonts. Kemudian, famili Secretin berevolusi dari farmili reseptor GPCR Adhesi sebelum pemisahan nematoda.
Bacaan lebih lanjut
sunting- "The G protein-coupled receptor repertoires of human and mouse". Proc. Natl. Acad. Sci. U.S.A. 100 (8): 4903–8. 2003. doi:10.1073/pnas.0230374100. PMC 153653 . PMID 12679517.
- "GPCR Reference Library". Diakses tanggal 11 August 2008.
Reference for molecular and mathematical models for the initial receptor response
- "The Nobel Prize in Chemistry 2012" (PDF). Diakses tanggal 10 October 2012.
Pranala luar
sunting- G-protein-coupled + receptors
- GPCR Cell Line Diarsipkan 2015-04-03 di Wayback Machine.
- "GPCR Database". IUPHAR Database. International Union of Basic and Clinical Pharmacology. Diakses tanggal 11 August 2008.
- "GPCRdb".
Data, diagrams and web tools for G protein-coupled receptors (GPCRs).
; "GPCRdb: the G Protein-Coupled Receptor Database – an Introduction". British Journal of Pharmacology. 173 (14): 2195–207. 2016. doi:10.1111/bph.13509. PMC 4919580 . PMID 27155948. - "G Protein-Coupled Receptors on the NET". Diakses tanggal 10 November 2010.
a classification of GPCRs
- "PSI GPCR Network Center". Diarsipkan dari versi asli tanggal 25 July 2013. Diakses tanggal 11 July 2013.
a Protein Structure Initiative:Biology Network Center aimed at determining the 3D structures of representative GPCR family proteins
- GPCR-HGmod, database model struktural 3D dari semua reseptor digabungkan protein G manusia, dibangun oleh pipa GPCR-I-TASSER "GPCR-I-TASSER: A Hybrid Approach to G Protein-Coupled Receptor Structure Modeling and the Application to the Human Genome". Structure. 23: 1538–49. August 2015. doi:10.1016/j.str.2015.06.007. PMC 4526412 . PMID 26190572.
Referensi
sunting- ^ a b "High-resolution crystal structure of an engineered human beta2-adrenergic G protein-coupled receptor". Science. 318 (5854): 1258–65. November 2007. doi:10.1126/science.1150577. PMC 2583103 . PMID 17962520.
- ^ a b "Action of molecular switches in GPCRs—theoretical and experimental studies". Current Medicinal Chemistry. 19 (8): 1090–109. 2012. doi:10.2174/092986712799320556. PMC 3343417 . PMID 22300046.
- ^ "Evolution of key cell signaling and adhesion protein families predates animal origins". Science. 301 (5631): 361–3. July 2003. doi:10.1126/science.1083853. PMID 12869759.
- ^ "It's a GPCR world". Modern Drug Discovery. American Chemical Society. 2004 (November): 24–28. 2004.
- ^ "How many drug targets are there?". Nature Reviews. Drug Discovery. 5 (12): 993–6. December 2006. doi:10.1038/nrd2199. PMID 17139284.
- ^ "Trends in GPCR drug discovery: new agents, targets and indications". Nature Reviews. Drug Discovery. 16 (12): 829–842. December 2017. doi:10.1038/nrd.2017.178. PMID 29075003.
- ^ a b "G proteins: transducers of receptor-generated signals". Annual Review of Biochemistry. 56 (1): 615–49. 1987. doi:10.1146/annurev.bi.56.070187.003151. PMID 3113327.
- ^ a b "Mammalian G proteins and their cell type specific functions". Physiological Reviews. 85 (4): 1159–204. October 2005. doi:10.1152/physrev.00003.2005. PMID 16183910.
- ^ a b "Pharmacogenomics of GPCR Drug Targets". Cell. 172 (1-2): 41–54.e19. January 2018. doi:10.1016/j.cell.2017.11.033. PMC 5766829 . PMID 29249361.
- ^ Royal Swedish Academy of Sciences (10 October 2012). "The Nobel Prize in Chemistry 2012 Robert J. Lefkowitz, Brian K. Kobilka". Diakses tanggal 10 October 2012.
- ^ "The Top Prescription Drugs of 2012 Globally: Biologics Dominate, But Small Molecule CNS Drugs Hold on to Top Spots" (PDF). ACS Chemical Neuroscience. Diakses tanggal 3 February 2016.
- ^ a b c "Comprehensive repertoire and phylogenetic analysis of the G protein-coupled receptors in human and mouse". Genomics. 88 (3): 263–73. September 2006. doi:10.1016/j.ygeno.2006.04.001. PMID 16753280.
- ^ "HGNC GPCR family members". HGNC. Diakses tanggal December 15, 2018.
- ^ "Phylogenetic analysis of 277 human G-protein-coupled receptors as a tool for the prediction of orphan receptor ligands". Genome Biology. 3 (11): RESEARCH0063. October 2002. doi:10.1186/gb-2002-3-11-research0063. PMC 133447 . PMID 12429062.
- ^ "Fingerprinting G-protein-coupled receptors". Protein Engineering. 7 (2): 195–203. February 1994. doi:10.1093/protein/7.2.195. PMID 8170923.
- ^ "GCRDb: a G-protein-coupled receptor database". Receptors & Channels. 2 (1): 1–7. 1994. PMID 8081729.
- ^ "International Union of Pharmacology. XLVI. G protein-coupled receptor list". Pharmacological Reviews. 57 (2): 279–88. June 2005. doi:10.1124/pr.57.2.5. PMID 15914470.
- ^
- ^ "The G protein-coupled receptor repertoires of human and mouse". Proceedings of the National Academy of Sciences of the United States of America. 100 (8): 4903–8. April 2003. doi:10.1073/pnas.0230374100. PMC 153653 . PMID 12679517. Diarsipkan dari versi asli tanggal 2020-08-28. Diakses tanggal 2019-01-20.
- ^ "GPCR-CA: A cellular automaton image approach for predicting G-protein-coupled receptor functional classes". Journal of Computational Chemistry. 30 (9): 1414–23. July 2009. doi:10.1002/jcc.21163. PMID 19037861. Diarsipkan dari versi asli tanggal 2017-04-09. Diakses tanggal 2019-01-20.
- ^ "Prediction of G-protein-coupled receptor classes based on the concept of Chou's pseudo amino acid composition: an approach from discrete wavelet transform". Analytical Biochemistry. 390 (1): 68–73. July 2009. doi:10.1016/j.ab.2009.04.009. PMID 19364489.
- ^ "Prediction of G-protein-coupled receptor classes in low homology using Chou's pseudo amino acid composition with approximate entropy and hydrophobicity patterns". Protein and Peptide Letters. 17 (5): 559–67. May 2010. doi:10.2174/092986610791112693. PMID 19594431.
- ^ "Sphingosine-1-phosphate suppresses TLR-induced CXCL8 secretion from human T cells". Journal of Leukocyte Biology. 93 (4): 521–8. April 2013. doi:10.1189/jlb.0712328. PMID 23345392.
- ^ "G protein-coupled receptors in the hypothalamic paraventricular and supraoptic nuclei—serpentine gateways to neuroendocrine homeostasis". Frontiers in Neuroendocrinology. 33 (1): 45–66. January 2012. doi:10.1016/j.yfrne.2011.07.002. PMC 3336209 . PMID 21802439.
- ^ "G-protein-coupled receptors and cancer". Nature Reviews. Cancer. 7 (2): 79–94. February 2007. doi:10.1038/nrc2069. PMID 17251915.
- ^ "Molecular signatures of G-protein-coupled receptors". Nature. 494 (7436): 185–94. February 2013. doi:10.1038/nature11896. PMID 23407534.
- ^ "Insights into the structure of class B GPCRs". Trends in Pharmacological Sciences. 35 (1): 12–22. January 2014. doi:10.1016/j.tips.2013.11.001. PMC 3931419 . PMID 24359917.
- ^ "Crystal structure of rhodopsin: A G protein-coupled receptor" (PDF). Science. 289 (5480): 739–45. August 2000. doi:10.1126/science.289.5480.739. PMID 10926528.
- ^ "Crystal structure of the human beta2 adrenergic G-protein-coupled receptor". Nature. 450 (7168): 383–7. November 2007. doi:10.1038/nature06325. PMID 17952055.
- ^ "GPCR engineering yields high-resolution structural insights into beta2-adrenergic receptor function". Science. 318 (5854): 1266–73. November 2007. doi:10.1126/science.1150609. PMID 17962519.
- ^ "Structure of a nanobody-stabilized active state of the β(2) adrenoceptor". Nature. 469 (7329): 175–80. January 2011. doi:10.1038/nature09648. PMC 3058308 . PMID 21228869.
- ^ "Structure and function of an irreversible agonist-β(2) adrenoceptor complex". Nature. 469 (7329): 236–40. January 2011. doi:10.1038/nature09665. PMC 3074335 . PMID 21228876.
- ^ "The structural basis for agonist and partial agonist action on a β(1)-adrenergic receptor". Nature. 469 (7329): 241–4. January 2011. doi:10.1038/nature09746. PMC 3023143 . PMID 21228877.
- ^ "Structure of an agonist-bound human A2A adenosine receptor". Science. 332 (6027): 322–7. April 2011. doi:10.1126/science.1202793. PMC 3086811 . PMID 21393508.
- ^ "Crystal structure of the β2 adrenergic receptor-Gs protein complex". Nature. 477 (7366): 549–55. September 2011. doi:10.1038/nature10361. PMC 3184188 . PMID 21772288.
- ^ "Cloning of adiponectin receptors that mediate antidiabetic metabolic effects". Nature. 423 (6941): 762–9. June 2003. doi:10.1038/nature01705. PMID 12802337.
- ^ a b "Inactive-state preassembly of G(q)-coupled receptors and G(q) heterotrimers". Nature Chemical Biology. 7 (10): 740–7. October 2011. doi:10.1038/nchembio.642. PMC 3177959 . PMID 21873996.
- ^ "beta-Arrestin: a protein that regulates beta-adrenergic receptor function". Science. 248 (4962): 1547–50. June 1990. doi:10.1126/science.2163110. PMID 2163110.
- ^ "The role of beta-arrestins in the termination and transduction of G-protein-coupled receptor signals". Journal of Cell Science. 115 (Pt 3): 455–65. February 2002. PMID 11861753.
- ^ "Distinct conformations of GPCR–β-arrestin complexes mediate desensitization, signaling, and endocytosis". PNAS. 114: 2562–2567. 2017. doi:10.1073/pnas.1701529114. PMC 5347553 . PMID 28223524.
- ^ "Functional competence of a partially engaged GPCR-β-arrestin complex". Nature Communications. 7: 13416. November 2016. doi:10.1038/ncomms13416. PMC 5105198 . PMID 27827372.
- ^ "GPCR-G Protein-β-Arrestin Super-Complex Mediates Sustained G Protein Signaling". Cell. 166: 907–19. 2016. doi:10.1016/j.cell.2016.07.004. PMID 27499021.
- ^ "The year in G protein-coupled receptor research". Mol. Endocrinol. 24 (1): 261–74. January 2010. doi:10.1210/me.2009-0473. PMID 20019124.
- ^ "Thrombin and platelet activation". Chest. 124 (3 Suppl): 18S–25S. September 2003. doi:10.1378/chest.124.3_suppl.18S. PMID 12970120.
- ^ "Some G protein heterotrimers physically dissociate in living cells". Proceedings of the National Academy of Sciences of the United States of America. 103 (47): 17789–94. November 2006. doi:10.1073/pnas.0607116103. PMC 1693825 . PMID 17095603.
- ^ "Activation of G protein-coupled receptors entails cysteine modulation of agonist binding". Journal of Molecular Structure (Theochem). 430: 57–71. 1998. doi:10.1016/S0166-1280(98)90217-2.
- ^ "Integrin and GPCR Crosstalk in the Regulation of ASM Contraction Signaling in Asthma". Journal of Allergy. 2012: 341282. 2012. doi:10.1155/2012/341282. PMC 3465959 . PMID 23056062.
- ^ Smith, Jeffrey S.; Nicholson, Lowell T.; Suwanpradid, Jutamas; Glenn, Rachel A.; Knape, Nicole M.; Alagesan, Priya; Gundry, Jaimee N.; Wehrman, Thomas S.; Atwater, Amber Reck (2018-11-06). "Biased agonists of the chemokine receptor CXCR3 differentially control chemotaxis and inflammation". Science Signaling. 11 (555). doi:10.1126/scisignal.aaq1075. ISSN 1937-9145. PMID 30401786.
- ^ "Social senses: G-protein-coupled receptor signaling pathways in Dictyostelium discoideum". Chemistry & Biology. 3 (4): 239–43. April 1996. doi:10.1016/S1074-5521(96)90103-9. PMID 8807851.
- ^ "A novel protein-protein interaction between a G protein-coupled receptor and the phosphatase SHP-2 is involved in bradykinin-induced inhibition of cell proliferation". The Journal of Biological Chemistry. 277 (43): 40375–83. October 2002. doi:10.1074/jbc.M202744200. PMID 12177051.
- ^ "G(i)-dependent localization of beta(2)-adrenergic receptor signaling to L-type Ca(2+) channels". Biophysical Journal. 79 (5): 2547–56. November 2000. doi:10.1016/S0006-3495(00)76495-2. PMC 1301137 . PMID 11053129.
- ^ a b "Membrane trafficking of G protein-coupled receptors". Annual Review of Pharmacology and Toxicology. 44 (1): 559–609. 2004. doi:10.1146/annurev.pharmtox.44.101802.121558. PMID 14744258.
- ^ "G-protein-coupled receptor kinase 2 and hypertension: molecular insights and pathophysiological mechanisms". High Blood Pressure & Cardiovascular Prevention. 20 (1): 5–12. March 2013. doi:10.1007/s40292-013-0001-8. PMID 23532739.
- ^ "Mechanisms of regulation of the expression and function of G protein-coupled receptor kinases". Cellular Signalling. 15 (11): 973–81. November 2003. doi:10.1016/S0898-6568(03)00099-8. PMID 14499340.
- ^ "The role of sequestration in G protein-coupled receptor resensitization. Regulation of beta2-adrenergic receptor dephosphorylation by vesicular acidification". The Journal of Biological Chemistry. 272 (1): 5–8. January 1997. doi:10.1074/jbc.272.1.5. PMID 8995214.
- ^ "The interaction of beta-arrestin with the AP-2 adaptor is required for the clustering of beta 2-adrenergic receptor into clathrin-coated pits" (PDF). The Journal of Biological Chemistry. 275 (30): 23120–6. July 2000. doi:10.1074/jbc.M002581200. PMID 10770944.
- ^ "The beta2-adrenergic receptor/betaarrestin complex recruits the clathrin adaptor AP-2 during endocytosis". Proceedings of the National Academy of Sciences of the United States of America. 96 (7): 3712–7. March 1999. doi:10.1073/pnas.96.7.3712. PMC 22359 . PMID 10097102.
- ^ "A trafficking checkpoint controls GABA(B) receptor heterodimerization". Neuron. 27 (1): 97–106. July 2000. doi:10.1016/S0896-6273(00)00012-X. PMID 10939334.
- ^ "Heterodimerization is required for the formation of a functional GABA(B) receptor". Nature. 396 (6712): 679–82. December 1998. doi:10.1038/25354. PMID 9872316.
- ^ Xue, Chaoyang, ed. (2012). "The origin of GPCRs: identification of mammalian like Rhodopsin, Adhesion, Glutamate and Frizzled GPCRs in fungi". PLOS ONE. 7 (1): e29817. doi:10.1371/journal.pone.0029817. PMC 3251606 . PMID 22238661.
- ^ "Independent HHsearch, Needleman—Wunsch-based, and motif analyses reveal the overall hierarchy for most of the G protein-coupled receptor families". Molecular Biology and Evolution. 28 (9): 2471–80. September 2011. doi:10.1093/molbev/msr061. PMID 21402729.