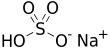Natrium bisulfat
Natrium bisulfat, dikenal pula sebagai natrium hidrogen sulfat,[1] adalah garam natrium dari anion bisulfat, dengan rumus molekul NaHSO4. Natrium bisulfat adalah garam asam yang dibentuk oleh netralisasi parsial asam sulfat oleh padanan natrium, biasanya dalam bentuk natrium hidroksida (alkali) atau natrium klorida (garam dapur). Senyawa ini adalah produk granular kering yang dapat dikirim dan disimpan dengan aman. Bentuk anhidratnya bersifat higroskopis. Larutan natrium bisulfat bersifat asam, dengan larutan 1M dari senyawa ini memiliki pH sekitar 1.
| |||

| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Natrium hidrogen sulfat
| |||
| Nama lain
Asam natrium sulfat
Bisulfat soda | |||
| Penanda | |||
| |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChemSpider | |||
| Nomor EC | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| NaHSO4 | |||
| Massa molar | 120.06 g/mol (anhidrat) 138.07 g/mol (monohidrat) | ||
| Penampilan | padatan putih | ||
| Densitas | 2.742 g/cm3 (anhidrat) 1.8 g/cm3 (monohidrat) | ||
| Titik lebur | 585 °C (1.085 °F; 858 K) (monohidrat) 315 °C (anhidrat) | ||
| Titik didih | terurai menjadi Na2S2O7 (+ H2O) pada 315 °C (599 °F; 588 K) | ||
| 28.5 g/100 mL (25 °C) 100 g/100 mL (100 °C) | |||
| Kelarutan | Tidak larut dalam amonia | ||
| Keasaman (pKa) | 1.99 | ||
| Struktur | |||
| triklinik (anhidrat) monoklinik (monohidrat) | |||
| Bahaya | |||
| Lembar data keselamatan | External MSDS | ||
| Frasa-R | R34 R37 R41 | ||
| Frasa-S | S26 S36 S37 S39 S45 | ||
| Titik nyala | Non-flammable | ||
| Senyawa terkait | |||
Anion lain
|
Natrium sulfat | ||
Kation lainnya
|
Kalium bisulfat | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Produksi
suntingNatrium bisulfat diproduksi sebagai zat antara dalam proses Mannheim, suatu proses industri yang melibatkan reaksi natrium klorida dan asam sulfat:[2]
- NaCl + H2SO4 → HCl + NaHSO4
Tahapan ini sangat eksotermis. Natrium bisulfat cair disemprotkan dan didinginkan sehingga membentuk manik padat. Gas hidrogen klorida dilarutkan dalam air untuk menghasilkan asam klorida sebagai produk hasil reaksi yang berguna.
Meskipun tidak menarik secara komersial, natrium bisulfat dapat dihasilkan sebagai produk sampingan dari produksi banyak asam mineral lainnya melalui reaksi garam natriumnya dengan kelebihan asam sulfat:
- NaX + H2SO4 → NaHSO4 + HX ( X− = CN−, NO3−, ClO4−)
Asam HX yang dihasilkan memiliki titik didih yang lebih rendah daripada reaktan dan dipisahkan dari campuran reaksi dengan distilasi.
Reaksi kimia
suntingNatrium bisulfat hidrat terhidrasi pada suhu 58 °C (136 °F) pada titik ketika ia terpisah dari molekul air yang melekat padanya. Setelah didinginkan lagi, baru ia bersifat higroskopis. Memanaskan natrium bisulfat pada suhu 280 °C (536 °F) menghasilkan natrium pirosulfat, garam tidak berwarna lainnya:[2]
- 2 NaHSO4 → Na2S2O7 + H2O
Kegunaan
suntingNatrium bisulfat digunakan terutama untuk menurunkan pH. Untuk aplikasi tingkat teknis, digunakan dalam penyelesaian logam, produk pembersih,[3] dan untuk menurunkan pH air untuk klorinasi yang efektif di kolam renang dan kolam air panas. Natrium bisulfat juga disetujui AAFCO sebagai aditif pakan penggunaan umum, termasuk makanan hewani pendamping. Senyawa ini digunakan sebagai pengasam urin untuk mengurangi batu kemih pada kucing.
Natrium bisulfat adalah bahan aktif utama dalam pembersih toilet kristal Vanish dan Sani-Flush, keduanya sekarang dihentikan.[4]
Dalam industri tekstil, senyawa ini terkadang diterapkan pada kain beludru yang dibuat dengan dukungan sutra dan tumpukan serat berbasis selulosa (rayon, kapas, rami, dan lain sebagainya) Untuk menciptakan "beludru burnout": natrium bisulfat, ketika diaplikasikan pada kain semacam itu dan dipanaskan, menyebabkan serat berbasis selulosa menjadi rapuh dan mengelupas, meninggalkan area yang terbakar pada bahan jadi, biasanya dalam pola yang menarik.[5]
Natrium bisulfat adalah bahan aktif dalam beberapa perawatan kotoran unggas granular yang digunakan untuk mengendalikan amonia.[6] Natrium bisulfat juga telah terbukti secara signifikan mengurangi konsentrasi Campylobacter dan Salmonella di rumah ayam.[7]
Dalam makanan
suntingNatrium bisulfat digunakan sebagai aditif makanan untuk campuran kue ragi (membuatnya mengembang)[8] serta digunakan dalam pemrosesan daging dan unggas dan yang terbaru dalam pencegahan kecoklatan pada produk potong segar.[9] Natrium bisulfat dianggap umumnya diakui sebagai aman (GRAS) oleh FDA. Produk tingkat makanan juga memenuhi persyaratan yang ditetapkan dalam Food Chemicals Codex. Senyawa ini dilambangkan dengan nomor E E514ii di UE dan juga disetujui untuk digunakan di Australia, Selandia Baru, Kanada, dan Meksiko.[10] dimana terdaftar sebagai aditif 514. Natrium bisulfat food-grade digunakan dalam berbagai produk makanan, termasuk minuman, dressing, saus, dan pengisi. Senyawa ini memiliki banyak sinonim termasuk[11] bisulfat soda, natrium asam sulfat, mono natrium hidrogen sulfat, natrium hidrogen sulfat, natrium hidrosulfat, dan garam natrium asam sulfat (1:1).
Referensi
sunting- ^ Awalan "bi" dalam "bisulfat" berasal dari sistem penamaan yang ketinggalan zaman dan didasarkan pada pengamatan bahwa terdapat dua kali lipat sulfat (SO4) dalam natrium bisulfat (NaHSO4) dan bisulfat lainnya seperti pada natrium sulfat (Na2SO4) dan sulfat lainnya.
- ^ a b Helmold Plessen (2000). "Sodium Sulfates". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_355. ISBN 978-3527306732.
- ^ John Toedt, Darrell Koza, Kathleen Van Cleef-Toedt Chemical Composition of Everyday Products p.147
- ^ SANI-FLUSH® Powder (Discontinued), Reckitt Benckiser.
- ^ Margo Singer (11 Juli 2007). Textile Surface Decoration: Silk and Velvet. University of Pennsylvania. hlm. 35. ISBN 978-0-8122-2000-1.
- ^ Blake, John P. "Litter Treatment for Poultry" (PDF). aces.edu. Alabama Cooperative Extension System. Diarsipkan dari versi asli (PDF) tanggal 2017-05-03.
- ^ "Campylobacter and Salmonella Populations Associated with Chickens Raised on Acidified Litter".[pranala nonaktif permanen]
- ^ "GRAS Notice 000003: Sodium bisulfate - FDA" (PDF). FDA.
- ^ "Sodium Bisulfate - USDA" (PDF). USDA.
- ^ Australia New Zealand Food Standards Code
- ^ "Noshly". Diarsipkan dari versi asli tanggal 2016-04-01. Diakses tanggal 2019-08-26.
Pranala luar
sunting| H2SO4 | He | ||||||||||||||||||
| Li2SO4 | BeSO4 | B | Ester ROSO−3 (RO)2SO2 |
(NH4)2SO4 N2H6SO4 (NH3OH)2SO4 |
O | F | Ne | ||||||||||||
| Na2SO4 NaHSO4 |
MgSO4 | Al2(SO4)3 Al2SO4(OAc)4 |
Si | P | SO2−4 | Cl | Ar | ||||||||||||
| K2SO4 KHSO4 |
CaSO4 | Sc2(SO4)3 | Ti(SO4)2 TiOSO4 |
VSO4 V2(SO4)3 VOSO4 |
CrSO4 Cr2(SO4)3 |
MnSO4 Mn2(SO4)3 |
FeSO4 Fe2(SO4)3 |
CoSO4 Co2(SO4)3 |
NiSO4 | CuSO4 Cu2SO4 |
ZnSO4 | Ga2(SO4)3 | Ge | As | Se | Br | Kr | ||
| RbHSO4 Rb2SO4 |
SrSO4 | Y2(SO4)3 | Zr(SO4)2 | Nb | Mo | Tc | Ru | Rh | PdSO4 | Ag2SO4 | CdSO4 | In2(SO4)3 | SnSO4 | Sb2(SO4)3 | Te | I | Xe | ||
| Cs2SO4 | BaSO4 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg2SO4 HgSO4 |
Tl2SO4 Tl2(SO4)3 |
PbSO4 | Bi2(SO4)3 | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La | Ce2(SO4)3 Ce(SO4)2 |
Pr2(SO4)3 | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb2(SO4)3 | Lu | |||||
| Ac | Th | Pa | U(SO4)2 UO2SO4 |
Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||