Antibodi
Antibodi (disingkat Ab), juga dikenal sebagai imunoglobulin (disingkat Ig),[1] adalah protein berukuran besar berbentuk huruf Y yang digunakan oleh sistem imun untuk mengidentifikasi dan menetralkan benda asing seperti bakteri dan virus patogen. Antibodi mengenali molekul unik milik patogen, yang disebut antigen.[2][3] Setiap ujung "Y" dari antibodi berisi paratop (dianalogikan dengan gembok) yang spesifik untuk satu epitop tertentu (dianalogikan dengan kunci) pada antigen, yang memungkinkan kedua struktur ini berikatan secara presisi. Dengan menggunakan mekanisme pengikatan ini, antibodi dapat menandai mikroorganisme atau sel yang terinfeksi untuk diserang oleh komponen sistem imun lainnya atau dapat menetralkannya secara langsung (misalnya dengan memblokir bagian dari virus yang penting untuk invasi).
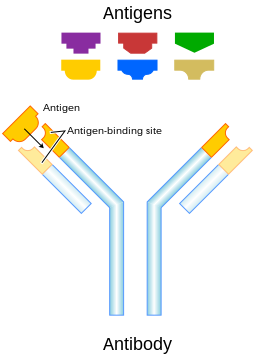
Untuk memungkinkan sistem imun mengenali jutaan antigen yang berbeda, situs pengikatan antigen di kedua ujung antibodi juga memiliki variasi yang sama banyaknya. Sementara itu, bagian antibodi sisanya relatif konstan. Antibodi punya beberapa varian yang menentukan kelas atau isotipe antibodi, yaitu IgA, IgD, IgE, IgG, atau IgM. Di batang tubuh antibodi yang relatif konstan, terdapat situs yang terlibat dalam interaksi dengan komponen sistem imun lainnya. Oleh karena itu, pembagian kelas tersebut menentukan fungsi yang dipicu oleh antibodi setelah mengikat antigen, selain perbedaan karakteristik struktural. Perbedaan kelas antibodi juga memengaruhi perbedaan tempat mereka dilepaskan di dalam tubuh dan pada tahapan respons imun apa.
Bersama dengan sel B dan sel T, antibodi merupakan bagian terpenting dari sistem imun adaptif. Mereka hadir dalam dua bentuk: melekat pada sel B atau dalam bentuk terlarut dalam cairan ekstraseluler seperti plasma darah. Awalnya, antibodi menempel ke permukaan sel B – mereka disebut sebagai reseptor sel B (BCR). Setelah antigen berikatan dengan BCR, sel B teraktivasi untuk berkembang biak dan berdiferensiasi menjadi sel plasma (yang mensekresikan antibodi-yang-dapat-larut dengan paratop yang sama) atau menjadi sel B memori (yang bertahan di dalam tubuh untuk mengaktifkan kekebalan jangka panjang terhadap antigen).[4] Antibodi yang larut dilepaskan ke dalam darah dan cairan ekstraseluler, serta banyak sekresi. Karena cairan juga disebut sebagai humor, imunitas yang dimediasi oleh antibodi kadang-kadang dikenal sebagai, atau dianggap sebagai bagian dari, imunitas humoral.[5] Unit berbentuk Y dapat berdiri sendiri sebagai monomer atau terangkai dalam kompleks molekul yang terdiri dari dua hingga lima unit.
Antibodi merupakan glikoprotein yang termasuk dalam superfamili imunoglobulin. Istilah antibodi dan imunoglobulin sering digunakan secara bergantian,[1] meskipun istilah 'antibodi' kadang-kadang digunakan untuk bentuk yang disekresikan dan larut, dengan kata lain, tidak termasuk reseptor sel B.[6]
Antibodi berperan pada imunitas tubuh sebagai pencegah patogen yang masuk atau merusak sel dengan cara mengikatnya, merangsang penghancuran patogen dengan melapisinya oleh makrofag dan sel lain; dan memicu kerusakan patogen dengan menstimulasi respon imun lain seperti jalur komplemen.[7]
Struktur
suntingAntibodi merupakan protein yang berat (~150 kDa) dengan ukuran sekitar 10 nm.[8] Molekul ini tersusun dalam tiga daerah globular yang secara kasar membentuk huruf Y.
Pada manusia dan kebanyakan mamalia, sebuah unit antibodi terdiri dari empat rantai polipeptida, yaitu dua rantai berat yang identik dan dua rantai ringan yang identik; mereka dihubungkan oleh ikatan disulfida.[9] Setiap rantai merupakan serangkaian domain: urutan yang agak mirip yang masing-masing terdiri atas sekitar 110 asam amino. Domain ini biasanya direpresentasikan dalam skema yang disederhanakan sebagai persegi panjang. Rantai ringan terdiri dari satu domain variabel VL dan satu domain konstan CL, sedangkan rantai berat berisi satu domain variabel VH dan tiga sampai empat domain konstan CH1, CH2, dan seterusnya.[10]
Secara struktural, antibodi juga dibagi menjadi dua fragmen pengikat antigen (Fab), yang masing-masing mengandung satu domain VL, VH, CL, dan CH1, serta fragmen yang dapat mengkristal (Fc), yang membentuk bagian batang huruf Y.[11] Di antara mereka terdapat daerah engsel rantai berat yang fleksibilitasnya memungkinkan antibodi untuk mengikat pasangan epitop pada berbagai jarak, untuk membentuk kompleks molekul (dimer, trimer, dll.), serta untuk mengikat molekul efektor dengan lebih mudah.[12]
Kelas
suntingAntibodi memiliki berbagai variasi yang dikenal sebagai isotipe atau kelas. Pada mamalia berplasenta, terdapat lima kelas antibodi yang dikenal sebagai IgA, IgD, IgE, IgG, dan IgM, yang selanjutnya dibagi lagi menjadi subkelas seperti IgA1, IgA2. Awalan "Ig" adalah singkatan dari imunoglobulin, sedangkan akhirannya menunjukkan jenis rantai berat yang dikandung antibodi: jenis rantai berat α (alfa), γ (gamma), δ (delta), ε (epsilon), dan μ (mu) yang merupakan dasar penamaan bagi IgA, IgG, IgD, IgE, dan IgM. Ciri khas setiap kelas ditentukan oleh bagian dari rantai berat di dalam engsel dan wilayah Fc.[2]
Tiap-tiap kelas memiliki perbedaan dalam sifat biologis, lokasi fungsional, dan kemampuan untuk menangani antigen, seperti yang digambarkan dalam tabel.[9] Misalnya, antibodi IgE bertanggung jawab atas respons alergi yang mencakup pelepasan histamin dari sel mast, yang berkontribusi pada asma. Wilayah variabel antibodi berikatan dengan antigen penyebab alergi, misalnya partikel tungau debu rumah, sedangkan wilayah Fc-nya (dalam rantai berat ε) berikatan dengan reseptor Fc ε pada sel mast, yang memicu degranulasinya (pelepasan molekul yang disimpan dalam granulanya).[13]
| Kelas | Subkelas | Deskripsi |
|---|---|---|
| IgA | 2 | IgA ditemukan di area mukosa, seperti usus, saluran pernapasan, dan saluran urogenital, serta mencegah kolonisasi oleh patogen;[14] juga ditemukan dalam air liur, air mata, dan ASI. |
| IgD | 1 | Fungsi IgD terutama sebagai reseptor antigen pada sel B yang belum terpapar antigen,[15] serta mengaktifkan basofil dan sel mast untuk menghasilkan faktor antimikrob.[16] |
| IgE | 1 | IgE mengikat alergen dan memicu pelepasan histamin dari sel mast dan basofil, dan terlibat dalam alergi, serta melindungi dari cacing parasitik.[5] |
| IgG | 4 | Dalam empat bentuknya, IgG memberikan sebagian besar kekebalan berbasis antibodi terhadap patogen yang menyerang. Satu-satunya antibodi yang mampu melewati plasenta untuk memberikan kekebalan pasif pada janin. |
| IgM | 1 | IgM diekspresikan di permukaan sel B (monomer) dan dalam bentuk tersekresi (pentamer) dengan aviditas yang sangat tinggi. Menghilangkan patogen pada tahap awal imunitas seluler B (humoral) sebelum IgG mencukupi.[5][15] |
Isotipe antibodi dari sel limfosit B berubah selama perkembangan dan aktivasi sel tersebut. Sel B belum matang, yang tidak pernah terpapar antigen, hanya mengekspresikan isotipe IgM dalam bentuk terikat di permukaan sel. Dalam bentuk yang siap merespons ini, limfosit B dikenal sebagai "limfosit B naif". Limfosit B naif mengekspresikan IgM dan IgD di permukaannya. Koekspresi dari kedua isotipe imunoglobulin ini membuat sel B siap untuk merespons antigen.[17] Aktivasi sel B mengikuti keterlibatan molekul antibodi (yang terikat-sel) dengan antigen, yang menyebabkan sel membelah dan berdiferensiasi menjadi sel penghasil antibodi yang disebut sel plasma. Dalam bentuk teraktivasi ini, sel B mulai memproduksi antibodi dalam bentuk tersekresikan alih-alih dalam bentuk terikat membran. Beberapa sel anak dari sel B yang teraktivasi mengalami peralihan isotipe, suatu mekanisme yang menyebabkan produksi antibodi berubah dari IgM atau IgD menjadi isotipe antibodi lain, IgE, IgA, atau IgG, yang memiliki peran tertentu dalam sistem imun.
Penerapan medis
suntingDiagnosa penyakit
Pada akhir abad ke-19, para ilmuwan yang menyelidiki penyakit menular mengembangkan teknik diagnostik baru beserta cara terapinya. Alat baru muncul dari pemahaman yang berkembang tentang sistem kekebalan dan peran antitoksin (antibodi) yang diproduksi tubuh sebagai respons terhadap organisme atau racun (antigen) yang menyerang. Para ilmuwan merancang tes untuk mendeteksi adanya antibodi dalam darah dan menggunakan antigen untuk memicu respons imun. Tes ini memberikan informasi mengenai riwayat penyakit pasien, termasuk infeksi yang sedang dialami serta paparan penyakit sebelumnya. Pengujian dapat mengungkap infeksi sebelum gejala luar muncul dan membantu mengidentifikasi pembawa penyakit atau individu tanpa gejala namun ia terpapar suatu penyakit.[18]
Terapi penyakit
Behring dan Kitasato menemukan terapi antibodi pasif yang dapat melindungi dari racun bakteri. Pada awal 1890-an dan 1930-an terapi serum digunakan secara luas untuk mengobati berbagai penyakit menular. Namun, popularitas terapi serum antibodi terjadi pada waktu yang hampir bersamaan dengan antibiotik pertama dikembangkan, dan antibiotik menjadi lebih banyak tersedia, sehingga penggunaan terapi serum menurun. Pada akhir 1940-an sebagian besar telah ditinggalkan. Preparat imunoglobulin tersedia untuk mengobati beberapa infeksi, seperti hepatitis B, rabies dan virus varicella-zoster, hanya satu antibodi monoklonal (palivizumab) yang telah dilisensikan untuk mencegah penyakit menular.[19]
Antibodi mampu memediasi berbagai efek biologis yang berbeda termasuk tidak bergantung pada komponen lain dari sistem kekebalan tubuh, seperti menetralkan racun dan virus, mengaktifkan komplemen, serta efek yang melibatkan komponen lain dari sistem kekebalan tubuh, seperti sitotoksisitas dan opsonisasi seluler yang bergantung pada antibodi. Selain itu, efek antibodi dapat sinergis dengan efek terapi antimikroba konvensional, dan waktu untuk mengembangkan sediaan antibodi terapeutik akan jauh lebih singkat daripada waktu pengembangan vaksin.[19]
Antibodi dapat dengan mudah dimodifikasi untuk menargetkan sel inang. Salah satu strateginya adalah radioimunoterapi, di mana radionuklida dilekatkan pada molekul antibodi.[19]
Terapi prenatal
Faktor Rhesus (Rh) yang juga disebut sebagai antigen Rh D merupakan antigen yang terdapat pada sel darah merah. Individu dengan Rh-positif (Rh +) memiliki antigen ini pada sel darah merahnya dan individu yang Rh-negatif (Rh–) tidak. Selama persalinan normal, trauma persalinan atau komplikasi selama kehamilan, darah dari janin dapat masuk ke dalam sistem tubuh ibu. Dalam kasus ibu dan anak yang memiliki ketidakcocokan Rh, pencampuran darah konsekuensial dapat membuat ibu Rh-sensitif terhadap antigen Rh pada sel darah anak Rh +, menempatkan sisa kehamilan, dan setiap kehamilan berikutnya bisa berisiko terhadap penyakit hemolitik pada bayi yang baru lahir.[20]
Pengobatan pranatal dengan diberikan Antibodi anti-RhD bertujuan untuk mencegah sensitisasi yang mungkin terjadi ketika ibu dengan Rh-negatif memiliki janin dengan Rh-positif. Pengobatan ibu dengan antibodi Anti-RhD sebelum dan sesaat setelah trauma persalinan menghancurkan antigen Rh dalam sistem ibu dari janin. Pengobatan Rho (D) Immune Globulin mencegah sensitisasi yang dapat menyebabkan penyakit Rh, tetapi tidak mencegah atau mengobati penyakit yang mendasari itu sendiri.[21]
Referensi
sunting- ^ a b Rhoades RA, Pflanzer RG (2002). Human Physiology (edisi ke-5th). Thomson Learning. hlm. 584. ISBN 978-0-534-42174-8.
- ^ a b Janeway, Charles (2001). Immunobiology (edisi ke-5th). Garland Publishing. ISBN 978-0-8153-3642-6.
- ^ Litman GW, Rast JP, Shamblott MJ, Haire RN, Hulst M, Roess W, Litman RT, Hinds-Frey KR, Zilch A, Amemiya CT (January 1993). "Phylogenetic diversification of immunoglobulin genes and the antibody repertoire". Molecular Biology and Evolution. 10 (1): 60–72. doi:10.1093/oxfordjournals.molbev.a040000. PMID 8450761.
- ^ Borghesi L, Milcarek C (2006). "From B cell to plasma cell: regulation of V(D)J recombination and antibody secretion". Immunologic Research. 36 (1–3): 27–32. doi:10.1385/IR:36:1:27. PMID 17337763.
- ^ a b c Pier GB, Lyczak JB, Wetzler LM (2004). Immunology, Infection, and Immunity. ASM Press. ISBN 978-1-55581-246-1.
- ^ "MeSH Browser – Immunoglobulins". meshb.nlm.nih.gov. Diakses tanggal 2020-10-25.
- ^ "Humoral Immune Response | Boundless Anatomy and Physiology". courses.lumenlearning.com. Diakses tanggal 2021-03-26.
- ^ Reth M (August 2013). "Matching cellular dimensions with molecular sizes" (PDF). Nature Immunology. 14 (8): 765–7. doi:10.1038/ni.2621. PMID 23867923. Diarsipkan dari versi asli (PDF) tanggal 2018-05-02. Diakses tanggal 2020-12-23.
- ^ a b Woof JM, Burton DR (February 2004). "Human antibody-Fc receptor interactions illuminated by crystal structures". Nature Reviews. Immunology. 4 (2): 89–99. doi:10.1038/nri1266. PMID 15040582.
- ^ Barclay AN (August 2003). "Membrane proteins with immunoglobulin-like domains—a master superfamily of interaction molecules". Seminars in Immunology. 15 (4): 215–23. doi:10.1016/S1044-5323(03)00047-2. PMID 14690046.
- ^ Putnam FW, Liu YS, Low TL (April 1979). "Primary structure of a human IgA1 immunoglobulin. IV. Streptococcal IgA1 protease, digestion, Fab and Fc fragments, and the complete amino acid sequence of the alpha 1 heavy chain". The Journal of Biological Chemistry. 254 (8): 2865–74. PMID 107164.
- ^ Delves, Peter J; Martin, Seamus J; Burton, Dennis R; Roitt, Ivan M (2017). Roitt's essential immunology (dalam bahasa Inggris) (edisi ke-13th). Chichester, West Sussex. ISBN 978-1-118-41577-1. OCLC 949912256.
- ^ Williams CM, Galli SJ (May 2000). "The diverse potential effector and immunoregulatory roles of mast cells in allergic disease". The Journal of Allergy and Clinical Immunology. 105 (5): 847–59. doi:10.1067/mai.2000.106485. PMID 10808163.
- ^ Underdown BJ, Schiff JM (1986). "Immunoglobulin A: strategic defense initiative at the mucosal surface". Annual Review of Immunology. 4 (1): 389–417. doi:10.1146/annurev.iy.04.040186.002133. PMID 3518747.
- ^ a b Geisberger R, Lamers M, Achatz G (August 2006). "The riddle of the dual expression of IgM and IgD". Immunology. 118 (4): 429–37. doi:10.1111/j.1365-2567.2006.02386.x. PMC 1782314 . PMID 16895553.
- ^ Chen K, Xu W, Wilson M, He B, Miller NW, Bengtén E, Edholm ES, Santini PA, Rath P, Chiu A, Cattalini M, Litzman J, B Bussel J, Huang B, Meini A, Riesbeck K, Cunningham-Rundles C, Plebani A, Cerutti A (August 2009). "Immunoglobulin D enhances immune surveillance by activating antimicrobial, proinflammatory and B cell-stimulating programs in basophils". Nature Immunology. 10 (8): 889–98. doi:10.1038/ni.1748. PMC 2785232 . PMID 19561614.
- ^ Goding JW (1978). "Allotypes of IgM and IgD receptors in the mouse: a probe for lymphocyte differentiation". Allotypes of IgM and IgD receptors in the mouse: A probe for lymphocyte differentiation. Contemporary Topics in Immunobiology. 8. hlm. 203–43. doi:10.1007/978-1-4684-0922-2_7. ISBN 978-1-4684-0924-6. PMID 357078.
- ^ "Diagnosing Disease with Antibodies". Smithsonian Institution (dalam bahasa Inggris). Diakses tanggal 2021-03-25.
- ^ a b c Casadevall, Arturo; Dadachova, Ekaterina; Pirofski, Liise-anne (2004-09). "Passive antibody therapy for infectious diseases". Nature Reviews Microbiology (dalam bahasa Inggris). 2 (9): 695–703. doi:10.1038/nrmicro974. ISSN 1740-1534.
- ^ Urbaniak, S. J.; Greiss, M. A. (2000-03-01). "RhD haemolytic disease of the fetus and the newborn". Blood Reviews (dalam bahasa Inggris). 14 (1): 44–61. doi:10.1054/blre.1999.0123. ISSN 0268-960X.
- ^ "Prevention of Rh Alloimmunization". Journal of Obstetrics and Gynaecology Canada (dalam bahasa Inggris). 25 (9): 765–773. 2003-09-01. doi:10.1016/S1701-2163(16)31006-4. ISSN 1701-2163.
Pranala luar
sunting- Mike's Immunoglobulin Structure/Function Page Diarsipkan 1997-08-06 di Wayback Machine. at University of Cambridge
- Antibodies as the PDB molecule of the month Diarsipkan 2010-04-14 di Wayback Machine. Discussion of the structure of antibodies at Protein Data Bank
- Download Post UTME Past Questions and Answers pdf Diarsipkan 2020-10-01 di Wayback Machine.
- Microbiology and Immunology On-line Textbook
- A hundred years of antibody therapy
- How Lymphocytes Produce Antibody from Cells Alive!
- Antibody applications image library, University of Birmingham
- Images produced using antibodies Diarsipkan 2011-05-10 di Wayback Machine. at antibodypatterns.com
- Antibody database, search by reactivity, host species, applications and conjugate at biocompare.com
- Antibody Libraries[pranala nonaktif permanen] at creative-biolabs.com
- http://www.genetex.com/Web/ResearchArea/ResearchArea.aspx?Path=/Cancer&reAreaCode=01/ Cancer antibodies]