Substitusi asil nukleofilik
Substitusi asil nukleofilik[1] merupakan reaksi substitusi yang melibatkan nukleofil dan senyawa asil. Dalam jenis reaksi ini, nukleofil - seperti alkohol, amina, atau enolat - menggantikan posisi gugus pergi dari turunan asil - seperti asil halida, anhidrida asam, atau ester. Produk yang dihasilkan adalah karbonil - mengandung senyawa yang nukleofilnya telah menggantikan posisi gugus pergi yang terdapat pada derivat asil awal. Karena derivat asil bereaksi dengan berbagai nukleofil, dan karena produk dapat bergantung pada jenis tertentu dari derivat asil dan nukleofil yang terlibat, reaksi substitusi asil nukleofilik dapat digunakan untuk mensintesis berbagai produk yang berbeda.
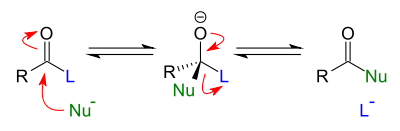
Mekanisme reaksi
suntingSenyawa karbonil bereaksi dengan nukleofil melalui mekanisme adisi: nukleofil menyerang karbon karbonil, membentuk zat antara tetrahedral. Reaksi ini dapat dipercepat dengan kondisi asam, yang membuat karbonil lebih elektrofilik, atau kondisi basa, yang menyediakan kondisi lebih anionik dan karenanya nukleofil menjadi lebih reaktif. Zat antara tetrahedral sendiri dapat berupa alkohol atau alkoksida, tergantung pada pH reaksi.
Zat antara tetrahedral pada suatu senyawa asil yang mengandung substituen yang menempel pada karbon pusat dapat bertindak sebagai gugus pergi. Setelah zat antara tetrahedral terbentuk, kemudian terpecah, membentuk kembali ikatan karbonil C=O dan melepaskan gugus pergi dalam reaksi eliminasi. Sebagai hasil dari proses adisi/eliminasi dua tahap ini, nukleofil menggantikan posisi gugus pergi pada senyawa karbonil dengan cara dari suatu keadaan antara yang tidak mengandung karbonil. Kedua tahapan diatas bersifat bolak-balik dan karenanya, reaksi substitusi asil nukleofilik merupakan proses kesetimbangan.[2] Karena kesetimbangan akan mendukung produk yang mengandung nukleofil terbaik, gugus pergi harus menjadi nukleofil yang relatif buruk agar reaksi menjadi praktis.
Kondisi asam
suntingDalam kondisi asam, gugus karbonil senyawa asil 1 terprotonasi, yang membuatnya teraktivasi ke arah penyerangan nukleofil. Pada tahap kedua, karbonil terprotonasi (2) diserang oleh nukleofil (H−Z) menghasilkan zat antara tetrahedral 3. Transfer proton dari nukleofil (Z) pada gugus pergi (X) menghasilkan 4, yang kemudian pecah melepaskan gugus pergi terprotonasi (H−X), menghasilkan senyawa karbonil terprotonasi 5. Lepasnya proton menghasilkan produk substitusi, 6. Karena tahap akhir melibatkan pelepasan proton, Reaksi substitusi asil nukleofilik dianggap katalitik dalam asam. Perlu diperhatikan pula bahwa dalam kondisi asam, nukleofil biasanya akan hadir dalam bentuk terprotonasi (dalam hal ini H−Z dan bukan Z−).
Kondisi basa
suntingDalam kondisi basa, suatu nukleofil (Nuc) menyerang gugus karbonil senyawa asil 1 untuk menghasilkan zat antara alkoksida tetrahedral 2. zat antara terpecah dan mengusir gugus pergi (X) untuk memberikan produk substitusi 3.
Mekanisme ini didukung oleh eksperimen pelabelan isotop. Ketika etil propionat dengan gugus etoksi berlabel-oksigen-18 diberi perlakuan dengan natrium hidroksida (NaOH), label oksigen-18 tidak terdapat dalam produk asam propionat dan terdapat secara eksklusif dalam etanol.[3]
Reaktivitas
suntingAda lima jenis utama dari derivatif asil. Asil halida yang paling reaktif terhadap nukleofil, diikuti oleh anhidrida, ester, dan amida. Ion karboksilat pada dasarnya tidak reaktif terhadap substitusi nukleofilik, karena mereka tidak memiliki gugus pergi. Sangat menarik untuk dicatat reaktivitas lima kelas senyawa ini mencakup berbagai hal; laju reaksi relatif asil klorida dan amida yang berbeda dengan faktor 1013.[4]
Reaksi pada turunan asil
suntingBanyak reaksi substitusi asil nukleofilik melibatkan konversi salah satu turunan asil ke lain. Secara umum, konversi antara turunan asil harus dimulai dengan sebuah senyawa yang relatif reaktif untuk satu yang kurang reaktif untuk menjadi praktis; klorida asam dapat dengan mudah dikonversi menjadi ester, tetapi mengubah sebuah ester langsung ke klorida asam pada dasarnya sulit. Ketika konversi antara turunan asil, produk akan selalu lebih stabil daripada senyawa awal.
Reaksi substitusi asil nukleofilik yang tidak melibatkan interkonversi antara turunan asil juga dimungkinkan. Misalnya, amida dan asam karboksilat bereaksi dengan pereaksi Grignard untuk menghasilkan keton. Ikhtisar reaksi yang masing-masing jenis asil derivatif dapat berpartisipasi disajikan berikut ini.
Asil halida
suntingAsil halida merupakan turunan asil yang paling reaktif, dan dapat dengan mudah dikonversi menjadi apapun yang lain. Asil halida akan bereaksi dengan asam karboksilat membentuk anhidrida. Jika struktur asam dan asil klorida berbeda, produk yang dihasilkan adalah anhidrida campuran. Pertama, asam karboksilat menyerang asil klorida (1) untuk menghasilkan zat antara tetrahedral 2. Zat antara tetrahedral terpecah, mendepak keluar ion klorida sebagai gugus pergi dan membentuk spesi oksonium 3. Deprotonasi menghasilkan anhidrida campuran, 4, dan suatu ekivalen HCl.
Alkohol dan amina bereaksi dengan asil halida untuk menghasilkan ester dan amida, masing-masing, dalam reaksi yang secara resmi dikenal sebagai reaksi Schotten-Baumann.[5] Asil halida menghidrolisis di hadapan air untuk menghasilkan asam karboksilat, tetapi tipe reaksi ini jarang bermanfaat karena asam karboksilat biasanya digunakan untuk mensintesis asil halida. Kebanyakan reaksi dengan asil halida dilakukan dengan adanya basa non-nukleofilik, seperti piridina, untuk menetralkan asil halida yang terbentuk sebagai produk samping.
Dalam asilasi Friedel–Crafts, asil halida berperan sebagai elektrofil pada substitusi elektrofilik aromatik. Suatu asam Lewis – seperti seng klorida (ZnCl2), besi(III) klorida (FeCl3), atau aluminium klorida (AlCl3) – berkoordinasi dengan halogen pada asil halida, mengaktivasi senyawa terhadap serangan nukleofilik oleh cincin aromatik teraktivasi. Terutama untuk cincin aromatik yang kaya elektron, reaksi akan dilanjutkan tanpa asam Lewis.[6]
Tioester
suntingReaksi kimia tioester dan asil halida hampir serupa, reaktivitasnya lebih ringan, dibandingkan asil klorida.
Anhidrida
suntingReaksi kimia anhidrida dan asil halida hampir serupa. Ketika anhidrida tidak dapat dikonversi ke asil halida, mereka dapat dikonversi ke turunan asil yang tersisa. Anhidrida juga berpartisipasi dalam reaksi jenis-Schotten-Baumann untuk memberikan ester dan amida dari alkohol dan amina, dan air dapat menghidrolisis anhidrida asam yang sesuai adanya. Seperti halnya asil halida, anhidrida juga dapat bereaksi dengan nukleofil karbon untuk memberikan keton dan/atau alkohol tersier, serta dapat berpartisipasi baik dalam asilasi Friedel-Crafts dan sintesis keton Weinreb.[6] Tidak seperti asil halida, tetapi, anhidrida tidak bereaksi dengan reagen Gilman.[3]
Reaktivitas anhidrida dapat ditingkatkan dengan menggunakan sejumlah katalis N,N-dimetilaminopiridin, atau DMAP. Piridina juga dapat digunakan untuk tujuan ini, dan berperan melalui mekanisme yang serupa.[5]
Pertama, DMAP (2) menyerang anhidrida (1) membentuk zat antara tetrahedral, yang kemudian terpecah untuk mengeliminasi ion karboksilat dan menghasilkan amida 3. Zat antara amida ini lebih teraktivasi terhadap serangan nukleofilik dari anhidrida awal, karena dimetilaminopiridin adalah gugus pergi yang lebih baik daripada karboksilat. Pada tahap akhir, nukleofil (Nuc) menyerang 3 menghasilkan zat antara tetrahedral lain. Ketika tetrahedral terpecah dan membentuk produk 4, gugus piridina dieliminasi dan aromatisitas nya dipulihkan – kekuatan pendorong yang kuat, dan menjadi alasan mengapa senyawa piridina merupakan gugus pergi yang lebih baik daripada ion karboksilat.
Ester
suntingEster kurang reaktif dari halida asam dan anhidrida. Seperti halnya turunan asil yang lebih reaktif, mereka dapat bereaksi dengan amonia dan amina primer dan sekunder untuk memberikan amida, meskipun tipe reaksi ini tidak sering digunakan, karena halida asam memberikan hasil yang lebih baik. Ester dapat dikonversi ke ester lainnya dalam proses yang dikenal sebagai transesterifikasi. Transesterifikasi dapat baik dikatalisasi oleh asam atau basa, serta melibatkan reaksi ester dengan alkohol. Sayangnya, karena gugus pergi juga merupakan alkohol, reaksi yang maju dan mundur akan sering terjadi pada laju yang sama. Menggunakan alkohol reaktan yang sangat berlebih atau menghilangkan gugus pergi alkohol (misal melalui distilasi) akan mendorong reaksi maju menuju penyelesaian, sesuai dengan prinsip Le Chatelier.[7]
Hidrolisis ester berkatalis asam juga merupakan proses kesetimbangan – hakikatnya merupakan kebalikan dari reaksi esterifikasi Fischer. Karena alkohol (yang bertindak sebagai gugus pergi) dan air (yang bertindak sebagai nukleofil) memiliki nilai pKa yang serupa, reaksi yang maju dan mundur bersaing satu sama lain. Seperti dalam transesterifikasi, menggunakan reaktan (air) yang sangat berlebih atau menghilangkan salah satu produk (alkohol) dapat mendukung reaksi ke depan.
Amida
suntingKarena reaktivitas yang rendah, amida tidak berpartisipasi dalam reaksi substitusi nukleofilik sama banyaknya seperti halnya turunan asil lain lakukan. Amida yang stabil terhadap air, dan kira-kira 100 kali lebih stabil terhadap hidrolisis dari ester.[4] Amida dapat, tetapi, dihidrolisis menjadi asam karboksilat dengan adanya asam atau basa. Stabilitas ikatan amida memiliki implikasi biologis, karena asam amino yang membentuk protein dihubungkan dengan ikatan amida. Ikatan amida cukup tahan terhadap hidrolisis untuk mempertahankan bentuk dan struktur protein di lingkungan berair, tapi cukup rentan bahwa mereka dapat rusak bila diperlukan.[4]
Asam karboksilat
suntingAsam karboksilat utamanya tidak reaktif terhadap substitusi nukleofilik, meskipun mereka dapat dikonversi ke turunan asil lainnya. Konversi asam karboksilat menjadi amida mungkin terjadi, tetapi tidak secara langsung. Alih-alih berperan sebagai nukleofil, amina akan bereaksi sebagai basa dalam kehadiran asam karboksilat untuk memberikan garam amonium karboksilat. Pemanasan garam di atas 100 °C akan mengusir air dan menyebabkan pembentukan amida. Metode sintesis amida merupakan hal yang penting secara industri, serta memiliki aplikasi laboratorium pula.[8] Dalam kehadiran katalis asam kuat, asam karboksilat dapat terkondensasi untuk membentuk anhidrida asam. Kondensasi tersebut menghasilkan air, tetapi, yang dapat menghidrolisis anhidrida kembali ke asam karboksilat awal. Dengan demikian, pembentukan anhidrida melalui kondensasi adalah proses kesetimbangan.
Dalam kondisi dikatalisis oleh asam, asam karboksilat akan bereaksi dengan alkohol membentuk ester melalui reaksi esterifikasi Fischer, yang juga merupakan proses kesetimbangan. Alternatif lain, diazometana dapat digunakan untuk mengkonversi asam menjadi ester. Ketika reaksi esterifikasi dengan diazometana sering memberikan hasil kuantitatif, diazometana hanya berguna untuk membentuk metil ester.[8]
Lihat pula
suntingReferensi
sunting- Catatan kaki
- ^ Penamaan yang benar seperti tercantum dalam Ilmukimia.org
"Ketika zat yang bereaksi merupakan senyawa aromatik, maka reaksi yang terjadi disebut dengan substitusi nukleofilik aromatik. Turunan asam karboksilat bereaksi dengan nukleofil dalam substitusi asil nukleofilik"
— Sumber - ^ Wade (2010), hlm. 996–997.
- ^ a b McMurry (1996), hlm. 820-821.
- ^ a b c Carey (2006), hlm. 866–868.
- ^ a b Kürti & Czakó (2005), hlm. 398.
- ^ a b Kürti & Czakó (2005), hlm. 176.
- ^ Wade (2010), hlm. 1005–1009.
- ^ a b Wade (2010), hlm. 964–965.
- Daftar pustaka
- Carey, Francis A. (2006). Organic Chemistry (dalam bahasa Inggris) (edisi ke-6). New York: McGraw-Hill. ISBN 0-072-82837-4.
- Kürti, László; Czakó, Barbara (2005). Strategic Applications of Named Reactions in Organic Synthesis (dalam bahasa Inggris). London: Elsevier Academic Press. ISBN 0-124-29785-4.
- Wade, L. G. (2010). Organic Chemistry (dalam bahasa Inggris) (edisi ke-7). New York: Pearson Prentice Hall. ISBN 0-321-59231-X.
- McMurry, John (1996). Organic Chemistry (dalam bahasa Inggris) (edisi ke-4). Pacific Grove, CA: Brooks/Cole Publishing Company. ISBN 0-534-23832-7.
Pranala luar
sunting- Reaksi anhidrida asetat dengan aseton dalam Denoon, Jr., C. E. (1955). Homer Adkins & Ivan A. Wolff, ed. "Acetylacetone". Organic Syntheses Coll. (dalam bahasa Inggris). 3: 16. doi:10.15227/orgsyn.020.0006.