Reaksi eliminasi
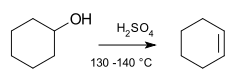
Reaksi eliminasi adalah salah satu jenis reaksi organik di mana dua substituen dipisahkan dari suatu molekul baik dalam mekanisme satu atau dua-tahap.[2] Mekanisme satu-tahap dikenal sebagai reaksi E2, dan mekanisme dua-tahap dikenal sebagai reaksi E1. Angka pada nama reaksi tidak berhubungan dengan jumlah tahapan dalam mekanisme tersebut, tetapi berkaitan dengan kinetika reaksi, bimolekular dan unimolekular berturut-turut. Dalam kasus yang jarang terjadi, untuk molekul yang memiliki gugus pergi yang buruk, jenis reaksi ketiga, E1CB, terjadi.
Mekanisme E2
suntingSelama tahun 1920-an, Sir Christopher Ingold mengusulkan suatu model untuk menjelaskan sebuah tipe ganjil dalam reaksi kimia: mekanisme E2. E2 merupakan singkatan dari eliminasi bimolekular. Reaksi tersebut melibatkan mekanisme satu-tahap di mana ikatan karbon-hidrogen dan karbon-halogen terputus untuk membentuk ikatan rangkap dua (ikatan pi C=C).
Karakteristik mekanisme reaksi ini diantaranya:
- E2 adalah eliminasi satu tahap, dengan satu keadaan transisi.
- Biasanya terjadi pada alkil halida primer tersubstitusi, tetapi mungkin terjadi pada alkil halida sekunder dan senyawa lainnya.
- Laju reaksinya mengikuti orde kedua, karena reaksi dipengaruhi baik oleh alkil halida dan basa (bimolekular).
- Karena mekanisme E2 menghasilkan pembentukan ikatan pi, dua gugus pergi (terkadang sebuah hidrogen dan suatu halogen) harus antiperiplanar. Keadaan transisi antiperiplanar memiliki konformasi goyang (staggered) dengan energi yang lebih rendah dibanding keadaan transisi sinperiplanar di mana konformasi eklips dengan energi yang lebih tinggi. Mekanisme reaksi yang melibatkan konformasi goyang lebih disukai pada reaksi E2 (tidak seperti reaksi E1).
- E2 biasanya menggunakan basa kuat. Basa harus cukup kuat untuk melepas hidrogen yang kurang asam.
- Agar ikatan pi dapat terbentuk, hibridisasi karbon harus lebih rendah dari sp3 menjadi sp2.
- Ikatan C-H dilemahkan dalam tahap penentu laju dan karenanya efek isotop deuterium primer lebih besar dari 1 (biasanya 2-6) teramati.
- E2 berkompetisi dengan mekanisme reaksi SN2 jika basa dapat bertindak pula sebagai nukleofil (pada banyak basa yang umum).
Contoh tipe reaksi ini dalam skema 1 adalah reaksi isobutilbromida dengan kalium etoksida dalam etanol. Produk reaksi tersebut adalah isobutilena, etanol dan kalium bromida.
Mekanisme E1
suntingE1 adalah suatu model untuk menjelaskan jenis tertentu dari reaksi eliminasi kimia. E1 merupakan singkatan dari eliminasi unimolekular serta memiliki karakteristik berikut.
- Merupakan proses eliminasi dua-tahap: ionisasi dan deprotonasi.
- Ionisasi: ikatan karbon-halogen putus menghasilkan zat antara karbokation.
- Deprotonasi karbokation.
- E1 umumnya terjadi pada alkil halida tersier, tetapi mungkin terjadi pada beberapa alkil halida sekunder.
- Laju reaksi dipengaruhi hanya oleh konsentrasi alkil halida karena pembentukan karbokation adalah tahap paling lambat, alias tahap penentu laju. Karenanya, kinetika orde pertama berlaku (unimolekular).
- Reaksi biasanya terjadi pada ketiadaan basa atau hanya dalam kehadiran basa lemah (kondisi asam dan suhu tinggi).
- Reaksi E1 berkompetisi dengan mekanisme reaksi SN1 karena keduanya berbagi zat antara karbokationik yang umum.
- Efek isotop deuterium sekunder yang agak lebih besar dari 1 (biasanya 1 - 1.5) teramati.
- Tidak dibutuhkan antiperiplanar. Contohnya pada pirolisis pada suatu ester sulfonat tertentu pada mentol:
- Hanya produk reaksi A yang dihasilkan dari eliminasi antiperiplanar. Kehadiran produk B adalah indikasi bahwa mekanisme E1 terjadi.[3]
- Reaksi ini disertai dengan reaksi penataan ulang karbokationik.
Contoh dalam skema 2 merupakan reaksi tert-butilbromida dengan kalium etoksida dalam etanol.
Eliminasi E1 terjadi dengan alkil halida yang sangat tersubstitusi karena dua alasan.
- Alkil halida yang sangat tersubstitusi sangat meruah, membatasi ruang bagi mekanisme satu-tahap E2; karenanya, mekanisme dua-tahap E1 lebih disukai.
- Kabokation yang sangat tersubstitusi lebih stabil dibanding kation tersubstitusi metil atau primer. Kestabilan tersebut memberi waktu bagai mekanisme dua-tahap E1 terjadi.
- Jika jalur reaksi SN1 dan E1 berkompetisi, jalur E1 dapat lebih disukai dengan peningkatan panas.
Lihat pula
suntingReferensi
sunting- ^ Coleman, G. H.; Johnstone, H. F. (1925). "Cyclohexene". Organic Syntheses. 5: 33. doi:10.15227/orgsyn.005.0033.
- ^ March, Jerry (1985). Advanced Organic Chemistry, Reactions, Mechanisms and Structure (dalam bahasa Inggris) (edisi ke-3). John Wiley & Sons. ISBN 0-471-85472-7.
- ^ Nash, J. J.; Leininger, M. A.; Keyes, K. (April 2008). "Pyrolysis of Aryl Sulfonate Esters in the Absence of Solvent: E1 or E2? A Puzzle for the Organic Laboratory". Journal of Chemical Education. 85 (4): 552. Bibcode:2008JChEd..85..552N. doi:10.1021/ed085p552.
Pranala luar
sunting- Media tentang Reaksi eliminasi di Wikimedia Commons
- Kutipan tentang Reaksi eliminasi di Wikikutip