Samarium(II) iodida
Samarium(II) iodida adalah sebuah senyawa anorganik dengan rumus SmI2. Ketika digunakan sebagai larutan untuk sintesis organik, senyawa ini dikenal sebagai pereaksi Kagan. SmI2 merupakan padatan berwarna hijau dan larutannya juga berwarna hijau. Ia adalah agen pereduksi satu elektron yang kuat yang digunakan dalam sintesis organik.
| |
| Nama | |
|---|---|
| Nama IUPAC
Samarium(II) iodida
| |
| Nama lain
Samarium diiodida
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| SmI2 | |
| Massa molar | 404,16 g/mol |
| Penampilan | Padatan hijau |
| Titik lebur | 520 °C (968 °F; 793 K) |
| Bahaya | |
| Titik nyala | Tak mudah terbakar |
| Senyawa terkait | |
Anion lain
|
Samarium(II) fluorida Samarium(II) klorida Samarium(II) bromida |
Kation lainnya
|
Samarium(III) iodida Europium(II) iodida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |

Struktur
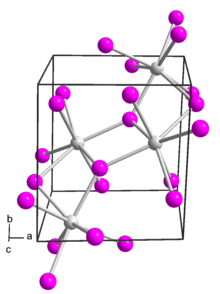
suntingDalam samarium(II) iodida, pusat logam samarium memiliki tujuh koordinat dengan geometri oktahedral bertudung-muka.[1]
Dalam aduk eternya, samarium tetap heptakoordinat dengan lima eter dan dua ligan iodida terminal.[2]
Pembuatan
suntingSamarium iodida mudah dibuat dengan hasil yang hampir kuantitatif dari logam samarium dan diiodometana atau 1,2-diiodoetana.[3] Ketika dibuat melalui cara ini, larutannya paling sering digunakan tanpa pemurnian pereaksi anorganik.
-
()
SmI2 padat dan bebas pelarut terbentuk melalui dekomposisi samarium(III) iodida (SmI3) pada suhu tinggi.[4][5][6]
Reaksi
suntingSamarium(II) iodida adalah zat pereduksi yang kuat – misalnya, ia dengan cepat mereduksi air menjadi hidrogen.[1] Senyawa ini tersedia secara komersial sebagai larutan berwarna biru tua dengan konsentrasi 0,1 M dalam THF. Meskipun biasanya digunakan dalam jumlah superstoikiometri, aplikasi katalitik telah dijelaskan.[7]
Kimia organik
suntingSamarium(II) iodida adalah pereaksi untuk pembentukan ikatan karbon–karbon, misalnya dalam reaksi Barbier (mirip dengan reaksi Grignard) antara keton dan alkil iodida untuk membentuk alkohol tersier:[8]
- R1I + R2COR3 → R1R2C(OH)R3
Kondisi reaksi tipikal menggunakan SmI2 dalam THF dengan adanya katalis NiI2.
Ester bereaksi dengan cara yang sama (menambahkan dua gugus R), tetapi aldehida menghasilkan produk sampingan. Reaksi ini sering digunakan karena sering kali sangat cepat (5 menit atau kurang dalam keadaan dingin). Meskipun samarium(II) iodida dianggap sebagai agen pereduksi elektron tunggal yang kuat, ia menunjukkan kemoselektivitas yang luar biasa di antara semua gugus fungsi. Sebagai contoh, sulfona dan sulfoksida dapat direduksi menjadi sulfida yang sesuai dengan adanya berbagai fungsionalitas yang mengandung karbonil (seperti ester, keton, amida, aldehida, dll.). Hal ini mungkin disebabkan oleh reaksi yang jauh lebih lambat dengan karbonil dibandingkan dengan sulfona dan sulfoksida. Selanjutnya, hidrodehalogenasi hidrokarbon terhalogenasi menjadi senyawa hidrokarbon yang sesuai dapat dilakukan dengan menggunakan samarium(II) iodida. Selain itu, hal ini juga dapat dipantau melalui perubahan warna yang terjadi saat warna biru tua dari SmI2 dalam THF berubah menjadi kuning muda setelah reaksi terjadi. Gambar menunjukkan warna gelap menghilang segera setelah kontak dengan campuran reaksi Barbier.
Pemurnian dilakukan dengan asam klorida encer, dan samarium dihilangkan sebagai Sm3+ encer.
Senyawa karbonil juga dapat digandengkan dengan alkena sederhana untuk membentuk cincin bersuku lima, enam, atau delapan.[9]
Gugus tosil dapat dihilangkan dari N-tosilamida hampir secara instan, dengan menggunakan SmI2 bersama dengan air suling dan basa amina. Reaksi ini bahkan efektif untuk menghilangkan substrat sensitif seperti aziridina:[10]
Dalam deoksigenasi Markó–Lam, suatu alkohol dapat dideoksigenasi hampir secara instan dengan mereduksi ester toluatnya dengan adanya SmI2.
Beberapa aplikasi SmI2 telah ditinjau.[11][12][13] Buku berjudul Organic Synthesis Using Samarium Diiodide, yang diterbitkan pada tahun 2009, memberikan gambaran rinci mengenai reaksi yang dimediasi oleh SmI2.[14]
Referensi
sunting- ^ a b Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ William J. Evans; Tammy S. Gummersheimer; Joseph W. Ziller (1995). "Coordination Chemistry of Samarium Diiodide with Ethers Including the Crystal Structure of Tetrahydrofuran-Solvated Samarium Diiodide, SmI2(THF)5". J. Am. Chem. Soc. 117 (35): 8999–9002. doi:10.1021/ja00140a016.
- ^ P. Girard, J. L. Namy and H. B. Kagan (1980). "Divalent Lanthanide Derivatives in Organic Synthesis. 1. Mild Preparation of SmI2 and YbI2 and Their Use as Reducing or Coupling Agents". J. Am. Chem. Soc. 102 (8): 2693–2698. doi:10.1021/ja00528a029.
- ^ G. Jantsch, N. Skalla: "Zur Kenntnis der Halogenide der seltenen Erden. IV. – Über Samarium(II)jodid und den thermischen Abbau des Samarium(III)jodids", Zeitschrift für Allgemeine und Anorganische Chemie, 1930, 193, 391–405; DOI:10.1002/zaac.19301930132.
- ^ G. Jantsch: "Thermischer Abbau von seltenen Erd(III)halogeniden", Die Naturwissenschaften, 1930, 18 (7), 155–155; DOI:10.1007/BF01501667.
- ^ Gmelins Handbuch der anorganischen Chemie, System Nr. 39, Band C 6, p. 192–194.
- ^ Huang, Huan-Ming; McDouall, Joseph J. W.; Procter, David J. (2019). "SmI2-catalysed cyclization cascades by radical relay". Nature Catalysis. 2 (3): 211–218. doi:10.1038/s41929-018-0219-x.
- ^ Machrouhi, Fouzia; Hamann, Béatrice; Namy, Jean-Louis; Kagan, Henri B. (1996). "Improved Reactivity of Diiodosamarium by Catalysis with Transition Metal Salts". Synlett. 1996 (7): 633–634. doi:10.1055/s-1996-5547.
- ^ Molander, G. A.; McKiie, J. A. (1992). "Samarium(II) iodide-induced reductive cyclization of unactivated olefinic ketones. Sequential radical cyclization/intermolecular nucleophilic addition and substitution reactions". J. Org. Chem. 57 (11): 3132–3139. doi:10.1021/jo00037a033.
- ^ Ankner, Tobias; Göran Hilmersson (2009). "Instantaneous Deprotection of Tosylamides and Esters with SmI2/Amine/Water". Organic Letters. American Chemical Society. 11 (3): 503–506. doi:10.1021/ol802243d. PMID 19123840.
- ^ Patrick G. Steel (2001). "Recent developments in lanthanide mediated organic synthesis". J. Chem. Soc., Perkin Trans. 1 (21): 2727–2751. doi:10.1039/a908189e.
- ^ Molander, G. A.; Harris, C. R. (1996). "Sequencing Reactions with Samarium(II) Iodide". Chem. Rev. 96 (1): 307–338. doi:10.1021/cr950019y. PMID 11848755.
- ^ K. C. Nicolaou; Shelby P. Ellery; Jason S. Chen (2009). "Samarium Diiodide Mediated Reactions in Total Synthesis". Angew. Chem. Int. Ed. 48 (39): 7140–7165. doi:10.1002/anie.200902151. PMC 2771673 . PMID 19714695.
- ^ Procter, David J.; Flowers,II, Robert A.; Skydstrup, Troels (2009). Organic Synthesis Using Samarium Diiodide. Royal Society of Chemistry. ISBN 978-1-84755-110-8.