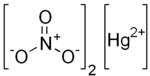
Raksa(II) nitrat
Raksa(II) nitrat adalah senyawa kristalin tidak berwarna atau berwarna putih dengan rumus kimia Hg(NO3)2. Senyawa ini pernah digunakan untuk membuat flanel dari bulu hewan. Praktik ini dilarang di Amerika Serikat pada Desember 1941. Ungapan "gila seperti pembuat topi" dalam bahasa Inggris ("mad as a hatter") konon terkait dengan penyakit psikologis yang muncul jika terlalu sering terpapar dengan senyawa ini. Namun, pelarangan tersebut bukan atas dasar kesehatan, tetapi karena raksa(II) nitrat sangat dibutuhkan dalam proses pembuatan bahan peledak selama Perang Dunia II.[1]
| |
| Nama | |
|---|---|
| Nama IUPAC
Raksa dinitrat
Raksa(II) nitrat | |
| Penanda | |
| |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
| Nomor UN | 1625 |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| Hg(NO3)2 | |
| Massa molar | 324.60 g/mol (anhidrat) |
| Penampilan | Kristal tidak berwarna atau bubuk putih |
| Bau | sharp |
| Densitas | 4.3 g/cm3 (monohidrat) |
| Titik lebur | 79 °C (174 °F; 352 K) (monohidrat) |
| Dapat larut | |
| Kelarutan | Dapat larut dalam asam nitrat, aseton, amonia Tidak dapat larut dalam alkohol |
| −74.0·10−6 cm3/mol | |
| Bahaya | |
| Lembar data keselamatan | ICSC 0980 |
Klasifikasi UE (DSD) (usang)
|
Sangat beracun (T+) Membahayakan lingkungan (N) |
| Frasa-R | R26/27/28, R33, R50/53 |
| Frasa-S | (S1/2), S13, S28, S45, S60, S61 |
| Titik nyala | Tidak mudah terbakar |
| Senyawa terkait | |
Anion lain
|
Raksa(II) sulfat Raksa(II) klorida |
Kation lainnya
|
Seng nitrat Kadmium nitrat |
Senyawa terkait
|
Raksa(I) nitrat |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Raksa(II) nitrat dibuat dengan mereaksikan asam nitrat yang panas dan terkonsentrasi dengan logam raksa. Dalam kondisi ini, asam nitrat berperan sebagai oksidator. Asam nitrat yang encer hanya akan menghasilkan raksa(I) nitrat.
Bahaya
suntingRaksa nitrat berdampak terhadap tubuh manusia seperti Hg2+. Jika raksa anorganik ditelan, raksa tersebut dapat mengubah struktur protein-protein yang penting di dalam tubuh. Jika terserap ke dalam tanah, raksa dapat diserap oleh tumbuhan.[2] Mereka yang mengalami keracunan raksa biasanya mengalami gejala muntah-muntah dan diare.[3]
Referensi
sunting- ^ "The Not-So-Mad Hatter: Occupational Hazards of Mercury". Diarsipkan dari versi asli tanggal 2018-06-19. Diakses tanggal 2018-06-19.
- ^ "Elemental Mercury and Inorganic Mercury Compounds:Human Health Aspects" (PDF).
- ^ "Mercuric Nitrate".
| HNO3 | He | ||||||||||||||||||
| LiNO3 | Be(NO''"; | B(NO''"; | C | N | O | FNO3 | Ne | ||||||||||||
| NaNO3 | Mg(NO''"; | Al(NO''"; | Si | P | S | ClONO2 | Ar | ||||||||||||
| KNO3 | Ca(NO''"; | Sc(NO''"; | Ti(NO''"; | VO(NO''"; | Cr(NO''"; | Mn(NO''"; | Fe(NO''"; | Co(NO''";, Co(NO''"; |
Ni(NO''"; | Cu(NO''"; | Zn(NO''"; | Ga(NO''"; | Ge | As | Se | Br | Kr | ||
| RbNO | Sr(NO''"; | Y | Zr(NO''"; | Nb | Mo | Tc | Ru | Rh | Pd(NO''"; | AgNO | Cd(NO''"; | In | Sn | Sb | Te | I | Xe(NO''"; | ||
| CsNO | Ba(NO''"; | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg, Hg(NO''"; |
Tl(NO''"; | Pb(NO''"; | Bi(NO''"; | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |||
| ↓ | |||||||||||||||||||
| La | Ce(NO''";, Ce(NO''"; |
Pr | Nd | Pm | Sm | Eu | Gd(NO''"; | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Th | Pa | UO | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||