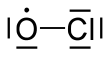Klorin monoksida
Klorin monoksida adalah suatu spesi radikal dengan rumus kimia ClO. Senyawa ini adalah gas berwarna merah-kuning, sangat reaktif dan tidak stabil. Senyawa ini biasanya disimpan dalam bentuk hidratnya pada bentuk beku. Senyawa ini digunakan sebagai pemutih kayu,[2] biosida[3] dan pembersihan air kolam renang.[4]
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC (preferensi)
Klorin monoksida | |||
| Nama IUPAC (sistematis)
Klorooksidanil | |||
| Nama lain
Klorin(II) oksida
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| Singkatan | ClO(.) | ||
| ChEBI | |||
| ChemSpider | |||
| Nomor EC | |||
| MeSH | Chlorosyl | ||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| ClO | |||
| Massa molar | 51,45 g·mol−1 | ||
| Termokimia | |||
| Entalpi pembentukan standar (ΔfH |
101.8 kJ/mol[1] | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Reaksi dan reaktivitas
suntingSenyawa ini meluruh dalam air, membentuk gas klorin dan oksigen.[4]
Senyawa ini meledak apabila dipanaskan atau apabila bereaksi dengan bahan organik, termasuk: karbon, karbon disulfida, eter, hidrokarbon, disianogen, bahan yang mudah teroksidasi (amonia, kalium, arsen, antimon, belerang, kalsium fosfida, fosfina, fosforus, hidrogen sulfida, antimon sulfida, barium sulfida, raksa sulfida, dan timah sulfida). Senyawa ini larut dalam basa, membentuk campuran klorit dan klorat.[4] Konsentrasi gas dari senyawa ini harus dibatasi hingga kurang dari 10% untuk mengurangi bahaya ledakan.
Peran dalam penipisan ozon
suntingZat ini berperan penting dalam proses penipisan ozon.[5] Di stratosfer, atom klor bereaksi dengan molekul ozon untuk membentuk klorin monoksida dan oksigen.[6]
- Cl· + O3 → ClO· + O2
Reaksi ini menyebabkan penipisan lapisan ozon.[1] Reaksi ini terus berlangsung dan radikal ClO· dapat bereaksi lebih lanjut:
- ClO· + O· → Cl· + O2
menghasilkan radikal klor. Dalam reaksi tersebut, keseluruhan reaksi peluruhan ozon dikatalisis oleh klor, karena klor pada akhirnya tidak mengalami perubahan. Persamaan reaksi secara keseluruhan adalah:
- O· + O3 → + 2O2
Penipisan ozon tersebut diakibatkan oleh penggunaan CFC yang meningkat. Karenanya, banyak negara menyetujui penggunaan CFC. Keadaan CFC yang nonreaktif membuatnya dapat melewati stratosfer, yang membuatnya mengalami fotodisosiasi untuk membentuk radikal Cl. Senyawa ini kemudian membentuk klorin monoksida, dan siklus ini terus berlanjut hingga dua radikal bereaksi untuk membentuk diklorin monoksida, yang mengakhiri reaksi radikal. Karena konsentrasi CFC di atmosfer sangat rendah, kemungkinan berakhirnya reaksi tersebut sangat rendah, berarti setiap radikal dapat meluruhkan ribuan molekul ozon.[7]
Walaupun penggunaan CFC telah dilarang di beberapa negara, CFC dapat berada di atmosfer hingga sekitar 50-500 tahun. Hal ini menyebabkan banyak radikal klor yang dihasilkan dan karenanya sejumlah molekul ozon mengalami peluruhan sebelum radikal klor mampu bereaksi dengan klorin monoksida untuk menghasilkan diklorin monoksida.
Referensi
sunting- ^ a b Egon Wiberg; Nils Wiberg; Arnold Frederick Holleman (2001). Inorganic chemistry (dalam bahasa Inggris). Academic Press. hlm. 462. ISBN 0-12-352651-5.
- ^ Kolar, J.J., Lindgren, B.O. & Pettersson, B. (1983). "Chemical reactions in chlorine dioxide stages of pulp bleaching". Wood Sci.Technol. (dalam bahasa Inggris). 17 (2): 117–128. doi:10.1007/BF00369129.
- ^ Mayack, Lynn A.; Soracco, Reginald J.; Wilde, Edward W.; Pope, Daniel H. (1984). "Comparative effectiveness of chlorine and chlorine dioxide biocide regimes for biofouling control". Water Research (dalam bahasa Inggris). 18 (5): 593–599. doi:10.1016/0043-1354(84)90209-4. ISSN 0043-1354.
- ^ a b c "CHLORINE MONOXIDE". CAMEO Chemicals (dalam bahasa Inggris). National Oceanic and Atmospheric Administration. Diakses tanggal 12 Mei 2015.
- ^ Anderson, J. G., Brune, W. H., dan Profitt, M. H. (1989). "Kinetics of O3 destruction by ClO and BrO within the Antarctic vortex: An analysis based on in situ ER-2 data". J. Geophys. Res. (dalam bahasa Inggris). 94 (D9): 11480–11520. doi:10.1029/JD094iD09p11480.
- ^ Brune, W. H., Anderson, J. G. (1986). "In situ observations of midlatitude stratospheric ClO and BrO". Geophys. Res. Lett. (dalam bahasa Inggris). 13 (13): 1391–1394. doi:10.1029/GL013i013p01391.
- ^ Mumma, M. J., Rogers, J. D., Kostiuk, T., Deming, D., Hillman, J. J., Zipoy, D. (1983). "Is there any chlorine monoxide in the stratosphere?". Science (dalam bahasa Inggris). 221 (4607): 268–271. doi:10.1126/science.221.4607.268.