Tritioaseton
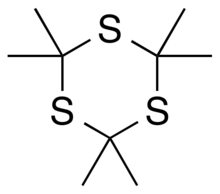
Tritioaseton (2,2,4,4,6,6-heksametil-1,3,5-tritiana) sebuah bahan kimia organik dengan rumus C9H18S3. Struktur kovalennya adalah [–C(CH3)2–S–]3, yaitu cincin beranggota enam dari atom karbon dan belerang yang berselang-seling, dengan dua gugus metil yang terikat pada setiap karbon.[2][4] Ia dapat dilihat sebagai turunan dari 1,3,5-tritiana, dengan substituen gugus metil untuk semua atom hidrogen dalam struktur induknya.
| |
| Nama | |
|---|---|
| Nama IUPAC (preferensi)
Heksametil-1,3,5-tritiana | |
| Nama lain
Tritioaseton[1]
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| Referensi Beilstein | 5-19-09-00119 |
| ChEMBL | |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C9H18S3 | |
| Massa molar | 222,42 g·mol−1 |
| Densitas | 1,0660 hingga 1,0700 g/mL[2] |
| Titik lebur | 21,8°C[3] |
| Titik didih | 107°C/10mmHg[2] |
| Indeks bias (nD) | 1,5390 hingga 1,5430[2] |
| Bahaya | |
| Piktogram GHS | 
|
| Keterangan bahaya GHS | {{{value}}} |
| H315, H319, H335 | |
| P261, P264, P271, P280, P302+352, P304+340, P305+351+338, P312, P321, P332+313, P337+313, P362, P403+233, P405, P501 | |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Senyawa tritioaseton adalah trimer siklik stabil dari tioaseton (propana-2-tiona), yang dengan sendirinya merupakan senyawa yang tak stabil.[5][6] Sebaliknya, senyawa trioksana analog, 2,2,4,4,6,6-heksametil-1,3,5-trioksana (triaseton), dengan atom oksigen menggantikan atom belerang, tampaknya tidak stabil, sedangkan aseton monomer yang sesuai (2-propanon) stabil.
Sintesis
suntingTritioaseton pertama kali dibuat pada tahun 1889 oleh Baumann dan Fromm, melalui reaksi hidrogen sulfida dengan aseton.[6] Dengan adanya katalis ZnCl2 yang diasamkan pada suhu 25 °C, diperoleh produk yang terdiri dari 60–70% tritioaseton, 30–40% 2,2-propanaditiol, dan sejumlah kecil dua pengotor isomer, 3,3,5,5,6,6-heksametil 1,2,4-tritiana dan 4-merkapto-2,2,4,6,6-pentametil-1,3-ditiana.[6] Produk tersebut juga dapat diperoleh dengan pirolisis alil isopropil sulfida.[7][8]
Reaksi
suntingPirolisis tritioaseton pada suhu 500–650 °C dan 5–20 mmHg menghasilkan tioaseton, yang dapat dikumpulkan dengan perangkap dingin pada suhu −78 °C.
Kegunaan
suntingTritioaseton ditemukan pada beberapa agen penyedap. Nomor FEMA-nya adalah 3475.[9][10][11][12]
Toksisitas
suntingLihat pula
sunting- 2,4,6-trimetil-1,3,5-tritiana
- Heksametilsiklotrisiloksana, analog dengan cincin silikon−oksigen, bukan cincin karbon−belerang.
- Heksametilsiklotrisilazana, dengan cincin silikon−nitrogen.[13]
- 2,2,4,4,6,6-heksametil-1,3,5-triselena-2,4,6-tristanasikloheksana, dengan cincin timah−selenium.[14][15]
Referensi
sunting- ^ "Trithioacetone". Lembar data kimia daring, diakses tanggal 22 Maret 2023.
- ^ a b c d TCI America (2020): "Product H1278: 2,2,4,4,6,6-Hexamethyl-1,3,5-trithiane". Halaman katalog daring, diakses tanggal 22 Maret 2023.
- ^ a b NCBI PubChem (2010): "2,2,4,4,6,6-Hexamethyl-1,3,5-trithiane". Lembar data kimia daring, diakses tanggal 22 Maret 2023.
- ^ David S. Breslow, Herman S. Award (2009): Multi-Sulfur and Sulfur and Oxygen Five- and Six-Membered Heterocycles, Bagian 2; halaman 712. Volume 68 dari Chemistry of Heterocyclic Compounds. ISBN 9780470188330
- ^ R. D. Lipscomb dan W. H. Sharkey (1970): "Characterization and polymerization of thioacetone". Journal of Polymer Science – Part A: Polymer Chemistry, volume 8, terbitan 8, halaman 2187–2196. DOI:10.1002/pol.1970.150080826
- ^ a b c William H. Sharkey (1979): "Polymerization through the carbon-sulfur double bond". Polymerization, seri Advances in Polymer Science, volume 17, halaman 73–103. DOI:10.1007/3-540-07111-3_2
- ^ William J. Bailey dan Hilda Chu (1965): "Synthesis of polythioacetone". ACS Polymer Preprints, volume 6, halaman 145–155
- ^ Horst Bohme, Hans Pfeifer, dan Erich Schneider (1942): "Dimeric thioketones". Berichte der Deutschen Chemischen Gesellschaft, volume 75B, terbitan 7, halaman 900–909. DOI:10.1002/cber.19420750722 Catatan: Laporan awal ini salah mengira trimer sebagai monomer.
- ^ a b E. J. Moran, O. D. Easterday, dan B. L. Oser (1980): "Acute oral toxicity of selected flavor chemicals". Drug and Chemical Toxicology, volume 3, terbitan 3, halaman 249–258.PMID 7449655 DOI:10.3109/01480548009002221
- ^ World Health Organization (1999): "Trithioacetone[pranala nonaktif]". Lembar data daring di Evaluation of the Joint FAO/WHO Expert Committee on Food Additives (JECFA). Diakses tanggal 22 Maret 2023.
- ^ G. Ohloff dan I. Flament (1979): "The Role of Heteroatomic Substances in the Aroma Compounds of Foodstuffs". Dalam Fortschritte der Chemie Organischer Naturstoffe (Kemajuan dalam Kimia Produk Alami Organik), volume 36, halaman 231–283. DOI:10.1007/978-3-7091-3265-4_2
- ^ EUR-Lex (2012): "Table entry 15.009: Trithioacetone". Dalam EU Regulation No. 872/2012, Dokumen 32012R0872, Official Journal of the EU – Series L, volume 267, halaman 1–161.
- ^ Stuart D. Brewer dan Charles P. Haber (1948): "Alkylsilazanes and Some Related Compounds". Journal of the American Chemical Society, volume 70, terbitan 11, halaman 3888–3891. DOI:10.1021/ja01191a106
- ^ B. M. Mikhova (2008), "NMR Data for Carbon-13 – C6H18Se3Sn3" dalam Landolt-Börnstein – Group III Condensed Matter, volume 35 Nuclear Magnetic Resonance Data, subvolume D5, Organometallic Compounds. DOI:10.1007/978-3-540-74189-3_1362
- ^ Martin Dräger, Axel Blecher, Hans-Jürgen Jacobsen, Bernt Krebs (1978): "Molekül- und kristallstruktur von hexamethylcyclo-tristannaselenan [(CH3)2SnSe]3". Journal of Organometallic Chemistry, volume 161, terbitan 3, halaman 319–325. DOI:10.1016/S0022-328X(00)92243-5