Uranium heksaklorida
Uranium heksaklorida (UCl
6) adalah sebuah senyawa kimia anorganik dari uranium dalam keadaan oksidasi +6.[1][2] UCl
6 merupakan halida logam yang terdiri dari uranium dan klorin. Senyawa ini adalah padatan kristalin hijau tua multi-luminesen dengan tekanan uap antara 1-3 mmHg pada suhu 373,15 K.[3] UCl
6 stabil dalam vakum, udara kering, nitrogen, dan helium pada suhu kamar. Ia larut dalam karbon tetraklorida (CCl
4). Dibandingkan dengan uranium halida lainnya, hanya sedikit yang diketahui mengenai UCl
6.
| |
| Nama | |
|---|---|
| Nama IUPAC
Uranium(VI) klorida
| |
| Nama lain
Uranium heksaklorida
Perurani klorida | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| |
| |
| Sifat | |
| UCl 6 | |
| Massa molar | 450,745 g/mol |
| Penampilan | Padatan kristalin hijau tua |
| Densitas | 3600 kg/m3 |
| Titik lebur | 177 °C (351 °F; 450 K) |
| Senyawa terkait | |
Anion lain
|
Uranium heksafluorida |
Kation lainnya
|
Wolfram heksaklorida |
Related Uranium klorida
|
|
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
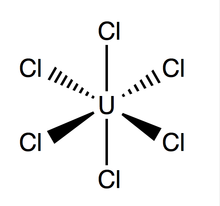
Struktur dan ikatan
suntingUranium heksaklorida memiliki geometri oktahedral, dengan grup titik Oh. Kisi senyawa ini (dimensi: 10,95 ± 0,02 Å × 6,03 ± 0,01 Å) berbentuk heksagonal dengan tiga molekul per sel; ikatan U–Cl teoretis rata-rata adalah 2,472 Å (panjang U–Cl eksperimental yang ditemukan melalui difraksi sinar-X adalah 2,42 Å),[4] dan jarak antara dua atom klorin yang berdekatan adalah 3,65 Å.
Sifat kimia
suntingUranium heksaklorida adalah senyawa yang sangat higroskopis dan mudah terurai ketika terpapar pada kondisi atmosfer biasa.[5] Oleh karena itu, senyawa ini harus ditangani dalam alat vakum atau dalam kotak kering.
Dekomposisi termal
suntingUCl
6 stabil hingga suhu antara 120 °C dan 150 °C. Dekomposisi UCl
6 menghasilkan transisi fase padat dari satu bentuk kristal UCl
6 ke bentuk lain yang lebih stabil.[6] Namun, penguraian gas UCl
6 menghasilkan UCl
5. Energi aktivasi untuk reaksi ini adalah sekitar 40 kcal per mol.
- 2 UCl
6 (g) → 2 UCl
5 (s) + Cl
2 (g)
Kelarutan
suntingUCl
6 bukanlah senyawa yang sangat mudah larut. Senyawa ini larut dalam CCl
4 untuk menghasilkan larutan berwarna cokelat. Ia sedikit larut dalam isobutil bromida dan fluorokarbon (C
7F
16).[6]
| Pelarut | Suhu (°C) | Gram UCl 6/100 g larutan |
|---|---|---|
| CCl 4 |
−18 | 2,64 |
| CCl 4 |
0 | 4,9 |
| CCl 4 |
20 | 7,8 |
| 6,6% Cl 2 : 93,4% CCl 4 |
−20 | 2,4 |
| 12,5% Cl 2 : 87,5% CCl 4 |
−20 | 2,23 |
| 12,5% Cl 2 : 87,5% CCl 4 |
0 | 3,98 |
| Cl 2 cair |
−33 | 2,20 |
| CH 3Cl |
−24 | 1,16 |
| Benzena | 80 | Tak larut |
| Freon 113 | 45 | 1,83 |
Reaksi dengan hidrogen fluorida
suntingKetika UCl
6 direaksikan dengan hidrogen fluorida (HF) cair anhidrat yang dimurnikan pada suhu kamar, ia akan menghasilkan UF
5.[6]
- 2 UCl
6 + 10 HF → 2 UF
5 + 10 HCl + Cl
2
Sintesis
suntingUranium heksaklorida dapat disintesis dari reaksi antara uranium trioksida (UO
3) dengan campuran CCl
4 cair dan klorin (Cl
2) panas. Hasil dapat ditingkatkan jika reaksi dilakukan dengan adanya UCl
5.[7] UO
3 diubah menjadi UCl
5, yang kemudian bereaksi dengan Cl
2 berlebih membentuk UCl
6. Dibutuhkan sejumlah besar panas agar reaksi ini dapat berlangsung; kisaran suhu mulai dari 65 °C hingga 170 °C, tergantung pada jumlah reaktan (suhu ideal 100 °C - 125 °C). Reaksi ini dilakukan dalam bejana kedap gas tertutup (misalnya kotak sarung tangan) yang dapat menahan tekanan yang terbentuk.
Langkah 1: 2 UO
3 + 5 Cl
2 → 2 UCl
5 + 3 O
2
Langkah 2: 2 UCl
5 + Cl
2 → 2 UCl
6
Reaksi keseluruhan: 2 UO
3 + 6 Cl
2 → 2 UCl
6 + 3 O
2
Heksahalida logam ini juga dapat disintesis dengan mengembuskan gas Cl
2 ke UCl
4 yang disublimasikan pada suhu 350 °C.[8]
Langkah 1: 2 UCl
4 + Cl
2 → 2 UCl
5
Langkah 2: 2 UCl
5 + Cl
2 → 2 UCl
6
Reaksi keseluruhan: UCl
4 + Cl
2 → UCl
6
Referensi
sunting- ^ Zachariasen, W. H. (1948). "Crystal chemical studies of the 5f-series of elements. V. The crystal structure of uranium hexachloride". Acta Crystallographica. 1 (6): 285–287. doi:10.1107/S0365110X48000788 .
- ^ Taylor, J. C.; Wilson, P. W. (1974). "Neutron and X-ray powder diffraction studies of the structure of uranium hexachloride". Acta Crystallographica Section B. 30 (6): 1481. doi:10.1107/S0567740874005115.
- ^ Van Dyke, R. E.; Evers, E. C. (1955). "Preparation of Uranium Hexachloride". Google Patents: 2.
- ^ Batista, E. R.; Martin, R. L.; Hay, P. J. (2004). "Density Functional Investigations of the Properties and Thermodynamics of UFn and UCln (n=1,...,6)". J. Chem. Phys. 121 (22): 11104–11. doi:10.1063/1.1811607. PMID 15634063.
- ^ Lipkin, D.; Wessman, S. (1955). "Process and Apparatus for protecting Uranium hexachloride from Deterioration and Contamination". Google Patents: 2.
- ^ a b c Katz, J.J.; Rabinowitch,E. (1951). The Chemistry of Uranium. Ann Arbor: The McGraw-Hill Book Company.
- ^ Van Dyke, R. E.; Evers, E. C. (1955). "Preparation of Uranium Hexachloride". Google Patents: 2.
- ^ Thornton, G.; Edelstein, N.; Rösch, N.; Woodwark, D.R.; Edgell, R.G. (1979). "The Electronic Structure of UCl6: Photoelectron Spectra and Scattered Wave Xα Calculations". J. Chem. Phys. 70 (11): 6. Bibcode:1979JChPh..70.5218T. doi:10.1063/1.437313.