Amonium tiosianat
Amonium tiosianat adalah senyawa anorganik dengan rumus kimia NH4SCN. Senyawa ini merupakan garam yang terdiri dari kation amonium dengan anion tiosianat.
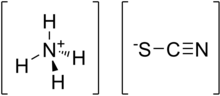
| |||
| |||
| Penanda | |||
|---|---|---|---|
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChemSpider | |||
| Nomor EC | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| NH4SCN | |||
| Massa molar | 76.122 g/mol | ||
| Penampilan | Kristalin higroskopik padat tak berwarna | ||
| Densitas | 1.305 g/cm3 | ||
| Titik lebur | 1.495 °C (2.723 °F; 1.768 K) | ||
| Titik didih | 170 °C (338 °F; 443 K) (dekomposisi) | ||
| 128 g/100 mL (0 °C) | |||
| Kelarutan | Larut dalam amonia, alkohol, aseton | ||
| -48.1·10−6 cm3/mol | |||
| Bahaya | |||
| Lembar data keselamatan | External MSDS | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Kegunaan
suntingAmonium tiosianat digunakan dalam proses produksi herbisida, tiourea, dan resin buatan yang transparan. Senyawa ini digunakan dalam korek api dan untuk menstabilisasi dalam bidang fotografi. Selain itu, amonium tiosianat digunakan dalam berbagai komposisi anti-karat, dipakai sebagai adjuvan dalam pewarnaan dan pencetakan tekstil, dipakai sebagai pelacak di ladang minyak, digunakan dalam proses pemisahan hafnium dari zirkonium, serta dipakai dalam analisis titrasi.
Amonium tiosianat juga dapat digunakan untuk mencari kandungan besi dalam minuman ringan lewat kolorimetri.
Persiapan
suntingAmonium tiosianat dibuat di Amerika Serikat dari reaksi karbon disulfida dengan amonia berair. Amonium ditiokarbamat dibentuk sebagai perantara dalam reaksi ini, yang akan berdekomposisi menjadi amonium tiosianat dan hidrogen sulfida setelah dipanaskan:
- CS2 + 2 NH3(aq) → NH2C(=S)SNH4 → NH4SCN + H2S
Reaksi
suntingAmonium tiosianat stabil dalam udara; namun, setelah dipanaskan, senyawa ini berisomerisasi menjadi tiourea:
Campuran setimbang pada suhu 150 °C dan 180 °C mengandung 30.3% dan 25.3% (berdasarkan massa) tiourea. Saat dipanaskan hingga mencapai suhu 200 °C, bubuk keringnya berdekomposisi menjadi amonia, hidrogen sulfida, dan karbon disulfida, sehingga menyisakan residu guanidinium tiosianat.
NH4SCN memiliki sifat asam yang lemah. Senyawa ini bereaksi dengan natrium hidroksida atau kalium hidroksida untuk membentuk natrium tiosianat atau kalium tiosianat. Senyawa ini bereaksi dengan garam besi untuk membentuk kompleks besi tiosianat merah:
- 6 SCN− + Fe3+ → [Fe(SCN)6]3−
Amonium tiosianat bereaksi dengan beberapa ion logam, termasuk tembaga, perak, seng, timbal, dan raksa, dan membentuk presipitat tiosianat yang dapat diekstrak ke pelarut organik.
Referensi
sunting- A. F. Wells, Structural Inorganic Chemistry, 5th ed., Oxford University Press, Oxford, UK, 1984. ISBN 978-0198553700

