Adiposit
Adiposit, juga dikenal sebagai liposit dan sel lemak, adalah sel yang terutama menyusun jaringan adiposa, terspesialisasi dalam menyimpan energi dalam bentuk lemak.[1] Adiposit diturunkan dari sel punca mesenkim yang menghasilkan adiposit, osteoblas, miosit, dan jenis sel lainnya melalui adipogenesis.
| Adiposit | |
|---|---|
 Jaringan adiposa kuning dalam parafin | |
| Rincian | |
| Pengidentifikasi | |
| Bahasa Latin | adipocytus |
| MeSH | D017667 |
| TH | H2.00.03.0.01005 |
| FMA | 63880 |
| Daftar istilah mikroanatomi | |
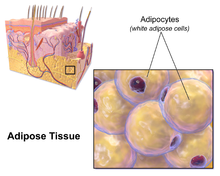
Kandungan lemak yang terbanyak pada adiposit adalah trigliserida dan kolesteril ester. Sekresi yang dihasilkan antara lain resistin, adiponektin, leptin, estradiol, angiotensin dan sitokina, interleukin.
Referensi
sunting- ^ Birbrair A, Zhang T, Wang ZM, Messi ML, Enikolopov GN, Mintz A, Delbono O (Agustus 2013). "Role of pericytes in skeletal muscle regeneration and fat accumulation". Stem Cells and Development. 22 (16): 2298–314. doi:10.1089/scd.2012.0647. PMC 3730538 . PMID 23517218.
Pranala luar
sunting- Histologi di UB 08201loa – "Jaringan Ikat: adiposit unilokular (putih)"
- Histologi di UB 04901lob – "Jaringan Ikat: adiposit multilokular (cokelat)"