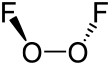Dioksigen difluorida
Dioksigen difluorida adalah senyawa kimia dengan rumus O2F2. Senyawa ini merupakan senyawa padat berwarna jingga yang melebur menjadi cairan merah pada suhu −163 °C (110 K). Senyawa ini merupakan oksidator yang sangat kuat dan dapat berdekomposisi menjadi oksigen dan fluor bahkan pada suhu −160 °C (113 K) dengan laju 4% setiap harinya; maka dari itu, senyawa ini tidak dapat bertahan lama dalam suhu ruangan.[1] Dioksigen difluorida bereaksi dengan hampir semua unsur yang ditemui.
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC (preferensi)
Dioksigen difluorida | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| Singkatan | FOOF | ||
| ChEBI | |||
| ChemSpider | |||
| Nomor EC | |||
| Referensi Gmelin | 1570 | ||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| O2F2 | |||
| Massa molar | 69.996 g·mol−1 | ||
| Penampilan | padat berwarna jingga | ||
| Densitas | 1.45 g/cm3 | ||
| Titik lebur | −154 °C (−245 °F; 119 K) | ||
| Titik didih | −57 °C (−71 °F; 216 K) hasil ekstrapolasi | ||
| Kelarutan | berdekomposisi | ||
| Termokimia | |||
| Kapasitas kalor (C) | 62.1 J/mol K | ||
| Entropi molar standar (S |
277.2 J/mol K | ||
| Entalpi pembentukan standar (ΔfH |
19.2 kJ/mol | ||
| Energi bebas Gibbs (ΔfG) | 58.2 kJ/mol | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Preparasi
suntingDioksigen difluorida dapat diperoleh dengan menempatkan campuran gas fluor dan oksigen dengan proporsi 1:1 pada tekanan rendah (7–17 mmHg (0.9–2.3 kPa) merupakan tekanan yang optimal) dengan transmisi listrik 25–30 mA pada tegangan 2.1–2.4 kV.[2] Metode serupa digunakan oleh Otto Ruff untuk mensintesiskan senyawa ini untuk pertama kalinya pada tahun 1933.[3] Metode sintesis lainnya adalah dengan mencampur O2 dan F2 ke dalam bejana baja nirkarat yang didinginkan hingga suhu −196 °C (77,1 K), dan kemudian unsur-unsur ini dipaparkan dengan 3 MeV bremsstrahlung selama beberapa jam. Metode ketiga adalah dengan pemanasan fluor dan oksigen hingga mencapai suhu 700 °C (1.292 °F), dan kemudian mendinginkannya dengan cepat dengan menggunakan oksigen cair.[4] Ketiga metode ini menggunakan reaksi berikut:
- O2 + F2 → O2F2
Dioksigen difluorida juga dapat diperoleh dari dekomposisi ozon difluorida:[5]
- O3F2 → O2F2 + ½ O2 or
- 2 O3F2 → 2 O2F2 + O2
Struktur dan properti
suntingDi dalam senyawa O2F2, oksigen memiliki bilangan oksidasi +1, sementara dalam senyawa-senyawa lainnya oksigen biasanya memiliki bilangan oksidasi −2.
Struktur dioksigen difluorida mirip dengan hidrogen peroksida, H2O2. Geometrinya sesuai dengan prediksi teori VSEPR:
Reaktivitas
suntingSenyawa ini dapat dengan mudah berdekomposisi menjadi oksigen dan fluor. Bahkan pada suhu −160 °C (113 K) 4% senyawa ini mengalami dekomposisi setiap harinya[1] lewat proses ini:
- O2F2 → O2 + F2
Senyawa ini juga merupakan oksidator yang kuat, walaupun sebagian besar reaksi dilakukan pada suhu yang mendekati −100 °C (173 K).[6] Sejumlah percobaan yang menggunakan senyawa ini telah mengakibatkan kebakaran dan ledakan. Beberapa senyawa yang dapat memicu ledakan dengan O2F2 adalah etil alkohol, metana, amonia dan bahkan es air.[6]
Jika bereaksi dengan BF3 dan PF5, akan dihasilkan garam dioksigenil:[1][7]
- 2 O2F2 + 2 PF5 → 2 [O2]+[PF6]− + F2
Referensi
sunting- ^ a b c Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. Academic Press. ISBN 0-12-352651-5.
- ^ Kwasnik, W. (1963). "Dioxygen Difluoride". Dalam Brauer, G. Handbook of Preparative Inorganic Chemistry. 1 (edisi ke-2nd). NY: Academic Press. hlm. 162.
- ^ Ruff, O.; Mensel, W. (1933). "Neue Sauerstofffluoride: O2F2 und OF". Zeitschrift für anorganische und allgemeine Chemie. 211 (1–2): 204–208. doi:10.1002/zaac.19332110122.
- ^ Mills, Thomas (1991). "Direct synthesis of liquid-phase dioxygen difluoride". Journal of Fluorine Chemistry. 52 (3): 267–276. doi:10.1016/S0022-1139(00)80341-3.
- ^ Kirshenbaum, A. D.; Grosse, A. V. (1959). "Ozone Fluoride or Trioxygen Difluoride, O3F2". Journal of the American Chemical Society. 81 (6): 1277. doi:10.1021/ja01515a003.
- ^ a b Streng, A. G. (1963). "The Chemical Properties of Dioxygen Difluoride". Journal of the American Chemical Society. 85 (10): 1380–1385. doi:10.1021/ja00893a004.
- ^ Solomon, Irvine J.; Brabets, Robert I.; Uenishi, Roy K.; Keith, James N.; McDonough, John M. (1964). "New Dioxygenyl Compounds". Inorganic Chemistry. 3 (3): 457. doi:10.1021/ic50013a036.
Pranala luar
sunting- Perfluoroperoxide dalam Linstrom, P.J.; Mallard, W.G. (eds.) NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD. http://webbook.nist.gov
- D. Lowe. "Things I Won't Work With: Dioxygen Difluoride". In the Pipeline. Diarsipkan dari versi asli tanggal 2017-10-11. Diakses tanggal 2018-02-24.