Stop kodon
Stop kodon atau Kodon stop (Inggris: Stop Codon) atau disebut juga "Terminasi kodon" atau "Penghentian kodon", di dalam molekuler biologi merupakan sebuah Kode genetik atau kodon (nukleotida triplet dalam messenger RNA) yang menandakan penghentian proses translasi pada protein.[1] Kebanyakan kodon dalam messenger RNA (mRNA) berhubungan dengan penambahan asam amino ke rantai polipeptida yang tumbuh, dan pada akhirnya dapat menjadi protein. Stop kodon akan memberi sinyal penghentian proses ini dengan mengikat faktor pelepasan, yang menyebabkan sub-unit ribosom terlepas, melepaskan rantai asam amino.
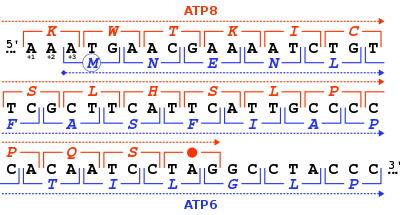
Properti sunting
Standar kodon sunting
Dalam kode genetik standar, ada tiga jenis kodon terminasi yang berbeda, yakni:
| Kodon | Kode Standar (Translasi tabel 1) |
Nama | ||
|---|---|---|---|---|
| DNA | RNA | |||
TAG |
UAG
|
STOP = Ter (*)
|
"amber" | |
TAA |
UAA
|
STOP = Ter (*)
|
"ochre" | |
TGA |
UGA
|
STOP = Ter (*)
|
"opal" (atau "umber") | |
Stop kodon alternatif sunting
Terdapat variasi pada kode genetik standar, dan stop kodon alternatif yang telah ditemukan dalam genom mitokondria dari vertebrate,[2] Scenedesmus obliquus,[3] dan Thraustochitrid.[4]
| Kode Genetik | Tabel Translasi |
Kodon | Translasi dengan kode ini |
Translasi standar | ||||
|---|---|---|---|---|---|---|---|---|
| DNA | RNA | |||||||
| Vertebrate mitochondrial | 2 | AGA |
AGA |
STOP = Ter (*) |
Arg (R)
| |||
AGG |
AGG |
STOP = Ter (*) |
Arg (R)
| |||||
| Scenedesmus obliquus mitochondrial | 22 | TCA |
UCA |
STOP = Ter (*) |
Ser (S)
| |||
| Thraustochytrium mitochondrial | 23 | TTA |
UUA |
STOP = Ter (*) |
Leu (L)
| |||
| sifat biokimia Amino-acid | Nonpolar | Polar | Basic | Acidic | Penghentian: stop kodon |
Penugasan ulang stop kodon sunting
Kode genetik inti fleksibel seperti yang diilustrasikan oleh varian kode genetik, akan menugaskan kembali stop kodon standar menjadi asam amino.[5]
| Kode genetik | Tabel translasi |
Kodon | Syarat translasi |
Standar translasi | ||||
|---|---|---|---|---|---|---|---|---|
| DNA | RNA | |||||||
| Nuklir Karaorelict | 27 | TGA |
UGA |
Ter (*) |
or | Trp (W) |
Ter (*)
| |
| Nuklir Condylostoma | 28 | TAA |
UAA |
Ter (*) |
or | Gln (Q) |
Ter (*)
| |
TAG |
UAG |
Ter (*) |
or | Gln (Q) |
Ter (*)
| |||
TGA |
UGA |
Ter (*) |
or | Trp (W) |
Ter (*)
| |||
| Nuklir Blastocrithidia | 31 | TAA |
UAA |
Ter (*) |
or | Glu (E) |
Ter (*)
| |
TAG |
UAG |
Ter (*) |
or | Glu (E) |
Ter (*)
| |||
Translasi sunting
Tahun 2007, kodon UGA diidentifikasi sebagai kodon yang mengkode selenosistein (Sec) dan ditemukan pula di 25 selenoprotein yang terdapat pada situs aktif protein. Kodon UAG dapat juga diterjemahkan ke dalam pirolisis (Pyl) dengan cara yang sama, dan terjemahan kodon ini diaktifkan oleh kedekatan elemen SECIS (SElenoCysteine Incorporation Sequence) atau Urutan Penggabungan SElenoCysteine.[6]
Distribusi genomik sunting
Pembagian stop kodon dalam genom suatu organisme tidak terjadi secara acak dan bisa jadi berkorelasi dengan konten GC.[7][8] Sebagai contoh, genom K-12 E. coli mengandung 2705 TAA (63%), 1257 TGA (29%), dan 326 TAG (8%) stop kodon (konten GC 50.8%).[9]
Substrat untuk stop kodon faktor pelepasan 1 atau faktor pelepasan 2 memiliki korelasi dengan kelimpahan stop kodon.[8] Skala besar studi tentang bakteri dengan berbagai kandungan GC menjelaskan bahwa frekuensi terjadinya TAA memiliki korelasi negatif dengan konten GC sementara frekuensi terjadinya TGA memiliki korelasi positif dengan konten GC, dan frekuensi terjadinya stop kodon TAG, menjadi paling sedikit dipakai dalam genom, dan tidak dipengaruhi oleh konten GC.[10]
Pengenalan sunting
Pengenalan stop kodon terhadap bakteri telah dikaitkan dengan sebutan 'antikodon tripeptida',[11] motif asam amino yang sangat dilestarikan di RF1 (PxT) dan RF2 (SPF). Walaupun hal ini telah didukung oleh sebuah studi struktural, namun terbukti bahwa hipotesis antikodon tripeptida merupakan sebuah penyederhanaan yang berlebihan.[12]
Sistem pemberian istilah sunting
Secara historis, stop kodon memiliki beragam nama yang berbeda, dan semuanya memiliki kaitan dengan kelas mutan yang berbeda namun semuanya berperilaku sama. Mutan ini terlebih dahulu diisolasi dalam bakteriofag (T4 dan lambda), virus yang menginfeksi bakteri Escherichia coli. Mutasi pada gen virus akan melemahkan kemampuan infeksi, dan ada kemungkinan akan menciptakan virus yang mampu menginfeksi dan tumbuh hanya dalam varietas E. coli tertentu.
Mutasi amber (UAG)
sunting
Mutasi amber merupakan rangkaian mutasi nonsense pertama yang ditemukan, kemudian diisolasi oleh Richard H. Epstein dan Charles Steinberg, lalu diberikan nama sesuai nama teman mereka yang juga seorang mahasiswa pascasarjana, Caltech Harris Bernstein, yang nama belakangnya dalam bahasa Jerman berarti "amber" (cf. Bernstein).[13][14]
Virus dengan mutasi amber memiliki ciri kemampuan untuk menginfeksi hanya strain bakteri tertentu, dan dikenal sebagai penekan amber. Bakteri ini akan membawa mutasinya sendiri berguna untuk pemulihan fungsi pada virus mutan. Contoh, mutasi pada tRNA yang mengenali stop kodon amber dan memungkinkan terjadi translasi untuk "membaca" kodon dan menghasilkan protein berukuran penuh. Maka bentuk protein akan pulih normal dan "menekan" terjadinya mutasi amber.[15]
Mutasi ochre (UAA)
sunting
Mutasi ochre merupakan mutasi stop kodon kedua yang telah ditemukan. Apabila warna-warna kuning-oranye-coklat memiliki asosiasi dengan mutasi amber, maka stop kodon yang diberi nama "ochre" ini, merupakan pigmen mineral yang memiliki asosisasi warna oranye-kemerahan-coklat.[14]
Virus mutan ochre memiliki kemiripan sifat dengan mutan amber yakni dapat memulihkan kemampuan infeksi dalam strain bakteri penekan tertentu. Kumpulan penekan oker berbeda dari penekan kuning, sehingga mutan oker disimpulkan sesuai dengan triplet nukleotida yang berbeda. Melalui serangkaian eksperimen mutasi yang membandingkan mutan ini satu sama lain dan kodon asam amino lain yang diketahui, Sydney Brenner menyimpulkan bahwa mutasi kuning dan oker berhubungan dengan triplet nukleotida "UAG" dan "UAA".[16]
Mutasi opal atau umber (UGA)
sunting
Kodon pemberhentian ketiga dan terakhir dalam kode genetik standar ditemukan segera setelah itu, dan sesuai dengan triplet nukleotida "UGA".[17] Untuk terus mencocokkan dengan tema mineral berwarna, kodon nonsense ketiga kemudian dikenal sebagai '"opal"' , yang merupakan sejenis silika yang menunjukkan berbagai warna.[14] Mutasi nonsens yang menciptakan kodon stop prematur ini kemudian disebut mutasi opal atau mutasi umber.
Mutasi sunting
Nonsense sunting
Mutasi nonsense adalah perubahan dalam urutan DNA yang memperkenalkan stop kodon prematur, dan menyebabkan protein yang dihasilkan dipendekkan secara tidak normal. Hal ini sering menyebabkan hilangnya fungsi protein, karena bagian penting dari rantai asam amino tidak terbentuk lagi. Secara terminologi stop kodon disebut juga dengan kodon nonsense.
Nonstop sunting
Sebuah mutasi nonstop adalah mutasi titik yang terjadi pada stop kodon. Mutasi nonstop menyebabkan terjemahan lanjutan untai mRNA ke wilayah yang seharusnya tidak diterjemahkan. Mutasi nonstop dikaitkan dengan berbagai penyakit bawaan, termasuk diantaranya Hiperplasia adrenal kongenital ( disingkat HAK, sebuah penyakit keturunan yang membuat penampilan fisik seorang wanita tampak lebih maskulin (ambigous genitalia)),[18] Disgenesis mesenkim segmen anterior,[19] Fibrosis kistik[20] dan ensefalomiopati neurogastrointestinal mitokondria.[21]
Hidden stop sunting
Hidden stop atau penghentian tersembunyi adalah kodon non-stop yang akan dibaca sebagai stop kodon apabila frameshift ed +1 atau −1. Stop ini akan diterjemahkan sebelum waktunya apabila terjadi pergeseran bingkai yang sesuai (seperti karena slip RNA ribosom) sebelum hidden stop terjadi. Kodon yang dapat membentuk hidden stop lebih sering digunakan pada genom dibandingkan dengan kodon sinonim yang mengkode asam amino. rRNA yang tidak stabil pada suatu organisme berkorelasi dengan frekuensi hidden stop yang lebih tinggi.[22] Namun hipotesis ini tidak dapat divalidasi tanpa bukti data yang lebih banyak.[23]
Pembacaan translasi sunting
Penekanan stop kodon atau disebut juga pembacaan translasi dapat terjadi apabila dalam terjemahan stop kodon stop diartikan sebagai kodon sense, yaitu ketika asam amino (standar) dikodekan oleh stop kodon. TRNA yang bermutasi dapat menjadi penyebab pembacaan, tetapi juga disebabkan oleh nukleotida tertentu yang berada dekat dengan stop kodon. Pembacaan atau penerjemahan translasi sangat umum terjadi pada virus dan bakteri, bahkan telah ditemukan sebagai prinsip pengaturan gen pada manusia, ragi, bakteri dan drosophila.[24][25] Jenis pembacaan translasi endogennya merupakan variasi dari kode genetik, karena stop kodon merupakan kode untuk asam amino. Untuk kasus enzim malate dehidrogenase pada manusia, stop kodon akan dibaca dengan frekuensi sekitar 4%.[26]
Referensi sunting
- ^ Griffiths AJF, Miller JH, Suzuki DT, Lewontin RC, Gelbart WM (2000). "Chapter 10 (Molecular Biology of Gene Function): Genetic code: Stop codons". An Introduction to Genetic Analysis. W.H. Freeman and Company.
- ^ Barrell, B. G.; Bankier, A. T.; Drouin, J. (1979-11-08). "A different genetic code in human mitochondria". Nature (dalam bahasa Inggris). 282 (5735): 189–194. doi:10.1038/282189a0. ISSN 0028-0836. PMID 226894.
- ^ A. M. Nedelcu, R. W. Lee, G. Lemieux, M. W. Gray, G. Burger (June 2000). "The complete mitochondrial DNA sequence of Scenedesmus obliquus reflects an intermediate stage in the evolution of the green algal mitochondrial genome". Genome Research. 10 (6): 819–831. doi:10.1101/gr.10.6.819. PMC 310893 . PMID 10854413.
- ^ Wideman, Jeremy G.; Monier, Adam; Rodríguez-Martínez, Raquel; Leonard, Guy; Cook, Emily; Poirier, Camille; Maguire, Finlay; Milner, David S.; Irwin, Nicholas A. T.; Moore, Karen; Santoro, Alyson E. (2019-11-25). "Unexpected mitochondrial genome diversity revealed by targeted single-cell genomics of heterotrophic flagellated protists". Nature Microbiology (dalam bahasa Inggris). 5 (1): 154–165. doi:10.1038/s41564-019-0605-4. hdl:10871/39819 . ISSN 2058-5276. PMID 31768028.
- ^ Swart, Estienne Carl; Serra, Valentina; Petroni, Giulio; Nowacki, Mariusz (2016). "Genetic Codes with No Dedicated Stop Codon: Context-Dependent Translation Termination". Cell. 166 (3): 691–702. doi:10.1016/j.cell.2016.06.020. PMC 4967479 . PMID 27426948.
- ^ Papp, Laura Vanda; Lu, Jun; Holmgren, Arne; Khanna, Kum Kum (2007). "From Selenium to Selenoproteins: Synthesis, Identity, and Their Role in Human Health". Antioxidants & Redox Signaling. 9 (7): 775–806. doi:10.1089/ars.2007.1528. PMID 17508906.
- ^ Povolotskaya IS, Kondrashov FA, Ledda A, Vlasov PK (2012). "Stop codons in bacteria are not selectively equivalent". Biology Direct. 7: 30. doi:10.1186/1745-6150-7-30. PMC 3549826 . PMID 22974057.
- ^ a b Korkmaz, Gürkan; Holm, Mikael; Wiens, Tobias; Sanyal, Suparna (2014). "Comprehensive Analysis of Stop Codon Usage in Bacteria and Its Correlation with Release Factor Abundance". The Journal of Biological Chemistry. 289 (44): 775–806. doi:10.1074/jbc.M114.606632. PMC 4215218 . PMID 25217634.
- ^ "Escherichia coli str. K-12 substr. MG1655, complete genome [Genbank Accession Number: U00096]". GenBank. NCBI. Diakses tanggal 2020-11-23.
- ^ Wong, Tit-Yee; Fernandes, Sanjit; Sankhon, Naby; Leong, Patrick P; Kuo, Jimmy; Liu, Jong-Kang (2008). "Role of Premature Stop Codons in Bacterial Evolution". Journal of Bacteriology. 190 (20): 6718–6725. doi:10.1128/JB.00682-08. PMC 2566208 . PMID 18708500.
- ^ Ito, Koichi; Uno, Makiko; Nakamura, Yoshikazu (1999). "A tripeptide 'anticodon' deciphers stop codons in messenger RNA". Nature. 403 (6770): 680–684. doi:10.1038/35001115. PMID 10688208.
- ^ Korkmaz, Gürkan; Sanyal, Suparna (2017). "R213I mutation in release factor 2 (RF2) is one step forward for engineering an omnipotent release factor in bacteria Escherichia coli". Journal of Biological Chemistry. 292 (36): 15134–15142. doi:10.1074/jbc.M117.785238. PMC 5592688 . PMID 28743745.
- ^ Stahl FW (1995). "The amber mutants of phage T4". Genetics. 141 (2): 439–442. PMC 1206745 . PMID 8647382.
- ^ a b c Lewin, Benjamin; Krebs, Jocelyn E.; Goldstein, Elliott S.; Kilpatrick, Stephen T. (2011-04-18). Lewin's Essential GENES (dalam bahasa Inggris). Jones & Bartlett Publishers. ISBN 978-1-4496-4380-5.
- ^ Robin Cook. "Amber, Ocher, and Opal Mutations Summary". World of Genetics. Gale.
- ^ Brenner, S.; Stretton, A. O. W.; Kaplan, S. (1965). "Genetic Code: The 'Nonsense' Triplets for Chain Termination and their Suppression". Nature. 206 (4988): 994–8. Bibcode:1965Natur.206..994B. doi:10.1038/206994a0. PMID 5320272.
- ^ Brenner, S.; Barnett, L.; Katz, E. R.; Crick, F. H. C. (1967). "UGA: A Third Nonsense Triplet in the Genetic Code". Nature. 213 (5075): 449–50. Bibcode:1967Natur.213..449B. doi:10.1038/213449a0. PMID 6032223.
- ^ Pang S.; Wang W.; et al. (2002). "A novel nonstop mutation in the stop codon and a novel missense mutation in the type II 3beta-hydroxysteroid dehydrogenase (3beta-HSD) gene causing, respectively, nonclassic and classic 3beta-HSD deficiency congenital adrenal hyperplasia". J Clin Endocrinol Metab. 87 (6): 2556–63. doi:10.1210/jc.87.6.2556. PMID 12050213.
- ^ Doucette, L.; et al. (2011). "A novel, non-stop mutation in FOXE3 causes an autosomal dominant form of variable anterior segment dysgenesis including Peters anomaly". European Journal of Human Genetics. 19 (3): 293–299. doi:10.1038/ejhg.2010.210. PMC 3062009 . PMID 21150893.
- ^ Guimbellot, Jennifer; Sharma, Jyoti; Rowe, Steven M. (November 2017). "Toward inclusive therapy with CFTR modulators: Progress and challenges". Pediatric Pulmonology. 52 (S48): S4–S14. doi:10.1002/ppul.23773. ISSN 1099-0496. PMC 6208153 . PMID 28881097.
- ^ Torres-Torronteras, J.; Rodriguez-Palmero, A.; et al. (2011). "A novel nonstop mutation in TYMP does not induce nonstop mRNA decay in a MNGIE patient with severe neuropathy" (PDF). Hum. Mutat. 32 (4): E2061–E2068. doi:10.1002/humu.21447. PMID 21412940.
- ^ Seligmann, Hervé; Pollock, David D. (2004). "The Ambush Hypothesis: Hidden Stop Codons Prevent Off-Frame Gene Reading". DNA and Cell Biology. 23 (10): 701–5. doi:10.1089/1044549042476910. PMID 15585128.
- ^ Cavalcanti, Andre; Chang, Charlotte H.; Morgens, David W. (2013). "Ambushing the ambush hypothesis: predicting and evaluating off-frame codon frequencies in Prokaryotic Genomes". BMC Genomics. 14 (418): 1–8. doi:10.1186/1471-2164-14-418. PMC 3700767 . PMID 23799949.
- ^ Namy O, Rousset JP, Napthine S, Brierley I (2004). "Reprogrammed genetic decoding in cellular gene expression". Molecular Cell. 13 (2): 157–68. doi:10.1016/S1097-2765(04)00031-0. PMID 14759362.
- ^ Schueren F, Lingner T, George R, Hofhuis J, Gartner J, Thoms S (2014). "Peroxisomal lactate dehydrogenase is generated by translational readthrough in mammals". eLife. 3: e03640. doi:10.7554/eLife.03640. PMC 4359377 . PMID 25247702.
- ^ Hofhuis J, Schueren F, Nötzel C, Lingner T, Gärtner J, Jahn O, Thoms S (2016). "The functional readthrough extension of malate dehydrogenase reveals a modification of the genetic code". Open Biol. 6 (11): 160246. doi:10.1098/rsob.160246. PMC 5133446 . PMID 27881739.