Sitoskeleton prokariotik
Sitoskeleton prokariotik adalah nama kolektif untuk semua filamen struktural dalam prokariota. Sebelumnya, sel-sel prokariotik dikira tidak memiliki sitoskeleton, tetapi kemajuan dalam teknologi visualisasi dan penentuan struktur mengarah pada penemuan filamen dalam sel-sel prokariotik pada awal 1990-an.[2] Analog untuk semua protein sitoskeletal utama dalam eukariota telah ditemukan di prokariota; tidak hanya itu, protein sitoskeletal tanpa homolog eukariotik yang dikenal juga telah ditemukan.[3][4][5][6] Unsur-unsur sitoskeletal memainkan peran penting dalam pembelahan sel, perlindungan, penentuan bentuk, dan penentuan polaritas di berbagai prokariota.[7][8]
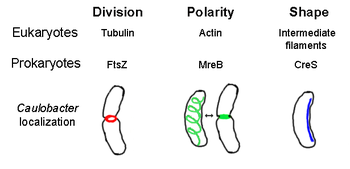
FtsZ sunting
FtsZ, unsur sitoskeletal prokariotik pertama yang diidentifikasi, membentuk struktur cincin berfilamen yang terletak di tengah sel yang disebut cincin Z (Z-ring) yang menyempit selama pembelahan sel, mirip dengan cincin kontraksi actin-myosin pada eukariota.[2] Cincin Z adalah struktur yang sangat dinamis yang terdiri dari banyak berkas protofilamen yang memanjang dan menyusut, meskipun mekanisme di balik kontraksi cincin Z dan jumlah protofilamen yang terlibat tidak jelas.[1] FtsZ bertindak sebagai protein pengorganisir dan diperlukan untuk pembelahan sel. FtsZ adalah komponen pertama dari septum selama sitokinesis, dan unsur sitoskeletal ini merekrut semua protein pembelahan sel lainnya yang diketahui ke situs pembelahan.[9]
Meskipun kesamaan fungsional dengan aktin ini, FtsZ adalah homolog dengan tubulin pada eukariota. Meskipun perbandingan struktur primer FtsZ dan tubulin mengungkapkan hubungan yang lemah, struktur 3 dimensinya sangat mirip. Selanjutnya, seperti tubulin, FtsZ monomerik terikat pada GTP dan berpolimerisasi dengan monomer FtsZ lainnya dengan hidrolisis GTP dalam mekanisme yang mirip dengan dimerisasi tubulin.[10] Karena FtsZ sangat penting untuk pembelahan sel dalam bakteri, protein ini adalah target untuk desain antibiotik baru.[11] Saat ini ada beberapa model dan mekanisme yang mengatur pembentukan cincin Z, tetapi mekanisme ini bergantung pada spesies. Beberapa spesies berbentuk batang, termasuk Escherichia coli dan Caulobacter crescentus, menggunakan satu atau lebih inhibitor perakitan FtsZ yang membentuk gradien bipolar dalam sel, meningkatkan polimerisasi FtsZ di pusat sel.[12]
MreB sunting
MreB adalah protein bakteri yang diyakini analog dengan aktin pada eukariota. MreB dan aktin memiliki kecocokan struktur primer yang lemah, tetapi sangat mirip dalam hal struktur tiga dimensi dan polimerisasi filamen.
Hampir semua bakteri yang tidak bulat bergantung pada MreB untuk menentukan bentuknya. MreB dirakit menjadi jaringan heliks dari struktur filamen tepat di bawah membran sel, meliputi seluruh panjang sel.[13] MreB menentukan bentuk sel dengan memediasi posisi dan aktivitas enzim yang mensintesis peptidoglikan dan dengan bertindak sebagai filamen kaku di bawah membran sel yang memberikan tekanan ke luar untuk membentuk dan menyokong sel.[1] MreB memadat dari jaringan heliks normal dan membentuk cincin ketat di septum di Caulobacter crescentus tepat sebelum pembelahan sel, mekanisme yang diyakini membantu menemukan septumnya yang tidak terletak di tengah.[14] MreB juga penting untuk penentuan polaritas dalam bakteri kutub, karena bertanggung jawab untuk posisi yang benar dari setidaknya empat protein kutub yang berbeda di C. crescentus.[14]
Kresentin sunting
Kresentin (Inggris: crescentin, dikode oleh gen creS) adalah analog dari filamen intermediat eukariotik. Berbeda dengan hubungan analog lain yang dibahas di sini, kresentin memiliki homologi dari struktur primer yang agak besar dengan protein filamen intermediat selain kesamaan tiga dimensi - urutan creS memiliki kecocokan identitas 25% dan kemiripan 40% dengan sitokeratin 19 dan kecocokan identitas 24% dan kesamaan 40% dengan lamin inti A. Selanjutnya, filamen kresentin kira-kira berdiameter 10 nm dan dengan demikian berada dalam kisaran diameter untuk filamen intermediat eukariota (8–15 nm).[15] kresentin membentuk filamen terus menerus dari kutub ke kutub di sepanjang sisi dalam yang cekung dari bakteri berbentuk sabit Caulobacter crescentus. Baik MreB dan kresentin diperlukan untuk C. crescentus agar C. crescentus dapat berbentuk sabit; diyakini bahwa MreB membentuk sel menjadi bentuk batang dan kresentin menekuk bentuk ini menjadi bulan sabit.[1]
Lihat pula sunting
Referensi sunting
- ^ a b c d Gitai Z (March 2005). "The new bacterial cell biology: moving parts and subcellular architecture". Cell. 120 (5): 577–86. doi:10.1016/j.cell.2005.02.026. PMID 15766522.
- ^ a b Bi EF, Lutkenhaus J (November 1991). "FtsZ ring structure associated with division in Escherichia coli". Nature. 354 (6349): 161–4. doi:10.1038/354161a0. PMID 1944597.
- ^ Gunning PW, Ghoshdastider U, Whitaker S, Popp D, Robinson RC (June 2015). "The evolution of compositionally and functionally distinct actin filaments". Journal of Cell Science. 128 (11): 2009–19. doi:10.1242/jcs.165563. PMID 25788699.
- ^ Popp D, Narita A, Lee LJ, Ghoshdastider U, Xue B, Srinivasan R, Balasubramanian MK, Tanaka T, Robinson RC (June 2012). "Novel actin-like filament structure from Clostridium tetani". The Journal of Biological Chemistry. 287 (25): 21121–9. doi:10.1074/jbc.M112.341016. PMC 3375535 . PMID 22514279.
- ^ Popp D, Narita A, Ghoshdastider U, Maeda K, Maéda Y, Oda T, Fujisawa T, Onishi H, Ito K, Robinson RC (April 2010). "Polymeric structures and dynamic properties of the bacterial actin AlfA". Journal of Molecular Biology. 397 (4): 1031–41. doi:10.1016/j.jmb.2010.02.010. PMID 20156449.
- ^ Wickstead B, Gull K (August 2011). "The evolution of the cytoskeleton". The Journal of Cell Biology. 194 (4): 513–25. doi:10.1083/jcb.201102065. PMC 3160578 . PMID 21859859.
- ^ Shih YL, Rothfield L (September 2006). "The bacterial cytoskeleton". Microbiology and Molecular Biology Reviews. 70 (3): 729–54. doi:10.1128/MMBR.00017-06. PMC 1594594 . PMID 16959967.
- ^ Michie KA, Löwe J (2006). "Dynamic filaments of the bacterial cytoskeleton" (PDF). Annual Review of Biochemistry. 75: 467–92. doi:10.1146/annurev.biochem.75.103004.142452. PMID 16756499. Diarsipkan dari versi asli (PDF) tanggal November 17, 2006.
- ^ Graumann PL (December 2004). "Cytoskeletal elements in bacteria". Current Opinion in Microbiology. 7 (6): 565–71. doi:10.1016/j.mib.2004.10.010. PMID 15556027.
- ^ Desai A, Mitchison TJ (July 1998). "Tubulin and FtsZ structures: functional and therapeutic implications". BioEssays. 20 (7): 523–7. doi:10.1002/(SICI)1521-1878(199807)20:7<523::AID-BIES1>3.0.CO;2-L. PMID 9722999.
- ^ Haydon DJ, Stokes NR, Ure R, Galbraith G, Bennett JM, Brown DR, Baker PJ, Barynin VV, Rice DW, Sedelnikova SE, Heal JR, Sheridan JM, Aiwale ST, Chauhan PK, Srivastava A, Taneja A, Collins I, Errington J, Czaplewski LG (September 2008). "An inhibitor of FtsZ with potent and selective anti-staphylococcal activity". Science. 321 (5896): 1673–5. doi:10.1126/science.1159961. PMID 18801997.
- ^ Haeusser DP, Margolin W (April 2016). "Splitsville: structural and functional insights into the dynamic bacterial Z ring". Nature Reviews. Microbiology. 14 (5): 305–19. doi:10.1038/nrmicro.2016.26. PMC 5290750 . PMID 27040757.
- ^ Kürner J, Medalia O, Linaroudis AA, Baumeister W (November 2004). "New insights into the structural organization of eukaryotic and prokaryotic cytoskeletons using cryo-electron tomography". Experimental Cell Research. 301 (1): 38–42. doi:10.1016/j.yexcr.2004.08.005. PMID 15501443.
- ^ a b Gitai Z, Dye N, Shapiro L (June 2004). "An actin-like gene can determine cell polarity in bacteria". Proceedings of the National Academy of Sciences of the United States of America. 101 (23): 8643–8. doi:10.1073/pnas.0402638101. PMC 423248 . PMID 15159537.
- ^ Ausmees N, Kuhn JR, Jacobs-Wagner C (December 2003). "The bacterial cytoskeleton: an intermediate filament-like function in cell shape". Cell. 115 (6): 705–13. doi:10.1016/S0092-8674(03)00935-8. PMID 14675535.