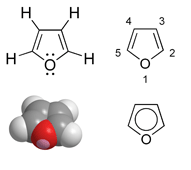
Furan
Furan, juga dikenal sebagai furfuran dan furana, adalah sejenis senyawa kimia heterosiklik. Ia umumnya diturunkan dari dekomposisi termal bahan-bahan yang mengandung pentosa (misalnya kayu tusam). Furan tidak berwarna, mudah terbakar, sangat mudah menguap dengan titik didih mendekati suhu kamar. Ia beracun dan kemungkinan karsinogenik. Hidrogenasi katalitik furan dengan katalis paladium menghasilkan tetrahidrofuran.
| |
| Nama | |
|---|---|
| Nama IUPAC
Furan
| |
| Nama lain
Oksola, furfuran, divinil oksida
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| Nomor EC | |
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| Sifat | |
| C4H4O | |
| Massa molar | 68,7 g/mol |
| Penampilan | takberawarna, cairan mudah menguap |
| Densitas | 0,936 g/mL |
| Titik lebur | -85,6 °C |
| Titik didih | 31,4 °C |
| Bahaya | |
| Titik nyala | -35 °C |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Sejarah sunting
Nama furan berasal dari Bahasa Latin furfur, yang berarti dedak.[1] Turunan furan yang pertama kali dideskripsikan adalah asam 2-furoat oleh Carl Wilhelm Scheele pada tahun 1780. Turunan lainnya yang penting adalah furfural, dilaporkan oleh Johann Wolfgang Döbereiner pada tahun 1831 dan dikarakterisasikan sembilan tahun kemudian oleh John Stenhouse. Furan sendiri pertama kali dibuat oleh Heinrich Limpricht pada tahun 1970, walaupun dia menamakannya tetrafenol.[2][3]
Sintesis dan isolasi sunting
- Furan bisa didapatkan dari furfural dengan oksidasi dan dekarboksilasi dari asam furan-2-dekarboksilat. Furfural bisa didapatkan dari distilasi destruktif dari inti jagung dengan keberadaan asam sulfat.[4]
- Sintesis organik klasik furan adalah sintesis Feist-Benary.
- Salah satu metode sintesis furan yang paling sederhana adalah reaksi 1,4-diketon dengan fosforus pentoksida (P2O5) dalam sintesis Paal-Knorr.
Kimia sunting
Furan bersifat aromatik karena satu pasangan menyendiri elektron pada atom oksigen terdelokalisasi ke dalam cincin, menghasilkan sistem aromatik 4n+2 (lihat kaidah Hückel) yang sama dengan benzena. Oleh karena aromatisitasnya, molekul berbentuk datar dan tidak mempunyai ikatan rangkap dua yang diskret.
Oleh karena aromatisitasnya, sifat-sifat furan berbeda dengan eter heterosiklik yang umumnya dijumpai seperti tetrahidrofuran.
- Ia lebih reaktif daripada benzena pada reaksi substitusi elektrofilik. Hal ini dikarenakan oleh efek pendonoran elektron dari heteroatom oksigen. Kajian pada kontributor resonansi menunjukkan peningkatan rapatan elektron cincin, mengakibatkan peningkatan laju substitusi elektrofilik.[5]
- Furan berperan sebagai diena pada reaksi Diels-Alder dengan dienolfil yang kekurangan elektron seperti etil (E)-3-nitroakrilat.[6] Produk reaksi berupa campuran isomer dengan preferensi isomer endo::
- Hidrogenasi furan menghasilkan dihidrofuran dan tetrahidrofuran.
- Dalam reaksi Achmatowicz, furan berubah menjadi senyawa dihidropiran.
Lihat pula sunting
- 2,5-Dimetilfuran, turunan furan yang berpotensi sebagai biofuel
- Tetrahidrofuran (THF), analog furan yang terhidrogenasi penuh dan merupakan pelarut yang umum.
- Pirola, analog nitrogen furan.
- Tiofena, analog sulfur furan.
- Selenofena, analog selenium furan.
- Telurofene, analog telurium furan.
- Benzofuran, furan dengan cincin benzena terpadu.
- Dibenzofuran, kelas senyawa yang sama dengan dibenzodioksin.
- Cincin aromatik sederhana
- Furanosa
Referensi sunting
- ^ Alexander Senning. Elsevier's Dictionary of Chemoetymology. Elsevier, 2006. ISBN 0-444-52239-5.
- ^ Limpricht, H. (1870). "Ueber das Tetraphenol C4H4O". Berichte der deutschen chemischen Gesellschaft. 3 (1): pp. 90–91. doi:10.1002/cber.18700030129.
- ^ Rodd, Ernest Harry (1971). Chemistry of Carbon Compounds: A Modern Comprehensive Treatise. Elsevier.
- ^ Wilson, W.C. (1941). "Furan". Org. Synth.; Coll. Vol. 1: 274.
- ^ Bruice, Paula Y. (2007). Organic Chemistry, Fifth Edition. Upper Saddle River, NJ: Pearson Prentice Hall. ISBN 0-13-196316-3.
- ^ Masesane I, Batsanov A, Howard J, Modal R, Steel P (2006). "The oxanorbornene approach to 3-hydroxy, 3,4-dihydroxy and 3,4,5-trihydroxy derivatives of 2-aminocyclohexanecarboxylic acid". Beilstein Journal of Organic Chemistry. 2 (9): 9. doi:10.1186/1860-5397-2-9. PMID 16674802.
Pranala luar sunting
- Furan on Computational Chemistry Wiki Diarsipkan 2006-10-02 di Wayback Machine.
- Recent synthetic methods Diarsipkan 2020-10-18 di Wayback Machine.